
分析 (1)根据题意,利用消耗硫酸的质量计算反应生成硫酸盐中金属与硫酸根的质量比,利用可能金属的化合价与相对原子质量讨论确定合金的组成;
(2)根据上述分析由硫酸锌的质量求出生成的氢气的质量和锌的质量;
(3)根据锌的质量可求出铜的质量,再求出该合金中含铜的质量分数.
解答 【解答】解:(1)滤液蒸干后得到固体纯净物32.2g中含硫酸根的质量=98g×20%×$\frac{96}{98}$×100%=19.2g
则所得硫酸盐中金属元素与硫酸根的质量比=(32.2g-19.2g):19.2g=65:96,此比例符合硫酸锌中锌与硫酸根的质量比,因此,可判断合金为铜锌合金;
(2)生成硫酸锌32.2g时生成氢气质量x,参加反应的锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
y 32.2g x
$\frac{65}{y}=\frac{161}{32.2g}=\frac{2}{x}$
解得:x=0.4g y=13g
(3)该合金中含铜的质量分数为:$\frac{20g-13g}{20g}×100%$=35%.
答:(1)此合金含有的另外一种金属是锌;
(2)生成氢气质量是0.4g;
(3)该合金中含铜的质量分数是35%.
点评 本题属于根据化学方程的计算判断混合物的组成,难度较大,旨在考查学生的运算能力、分析问题的能力,解答时理清思路才能顺利完成最终的计算.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO3溶液的pH<7 | B. | H2SO3中含有3个氧原子 | ||
| C. | 每个H2SO3分子中含一个SO3分子 | D. | H2SO3中氧元素的质量分数为19.5% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
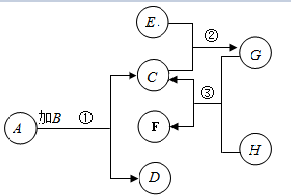 已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图:
已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com