
【题目】某同学做了如下图所示实验:
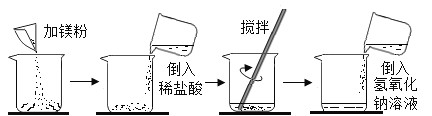
加入镁粉的质量 | m | m |
加入质量分数为14.6%稀盐酸的质量 | 50g | 100g |
加入氢氧化钠溶液的质量 | 100g | 100g |
加入氢氧化钠溶液后的实验现象 | 产生白色沉淀 | 无明显现象 |
第一次实验每步均恰好完全反应,请回答:
(1)写出第一次实验中发生反应的化学方程式:_____;
(2)第二次反应后溶液中溶质的组成是_____;
(3)每次实验加入镁的质量(m)为_____;
(4)求解第一次反应中生成气体的质量(X)的比例式为_____;
(5)若将第一次反应后溶液蒸发掉68.4 g水后,则所得不饱和溶液中溶质的质量分数是_____;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为_____。
【答案】Mg+2HCl===MgCl2+H2↑,MgCl2+2NaOH===Mg(OH)2↓+2NaCl NaCl、MgCl2 2.4g ![]() 15% 90 g
15% 90 g
【解析】
(1)镁和稀盐酸反应生成氯化镁和氢气、氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,反应的化学方程式分别是:
Mg+2HCl===MgCl2+H2↑、MgCl2+2NaOH===Mg(OH)2↓+2NaCl。
(2)第二次加入氢氧化钠溶液后无明显现象,即没有生成氢氧化镁沉淀,说明镁与稀盐酸反应时,稀盐酸过量,反应后溶液中溶质有镁和稀盐酸反应生成的氯化镁、氢氧化钠和稀盐酸反应生成的氯化钠。故填NaCl、MgCl2。
(3) 因为第一次实验每步均恰好完全反应,设镁的质量为x,生成氯化镁的质量为y,生成氢气的质量为z。

![]() ,解得x=2.4g
,解得x=2.4g
![]() ,解得y=9.5g
,解得y=9.5g
![]() ,解得z=0.2g
,解得z=0.2g
(4)第一次反应中生成气体的质量(X)的比例式为:![]() 。
。
(5)设生成氯化钠的质量为m,生成氢氧化镁的质量为n,
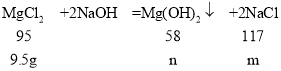
![]()
解得,m=11.7 g,n=5.8 g,
则所得不饱和溶液的质量为2.4 g+50 g+100 g-0.2 g-5.8 g-68.4 g=78 g,
则所得不饱和溶液中溶质的质量分数为:![]() =15%。
=15%。
(6)150 g稀盐酸中氯化氢的质量为150 g×14.6%=21.9 g,
需要36.5%的浓盐酸的质量为21.9 g÷36.5%=60 g,
需要水的质量为150 g-60 g=90 g。


科目:初中化学 来源: 题型:
【题目】科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。有关该反应的说法不正确的是
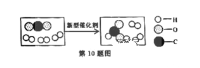
A. 该反应不属于化合反应 B. 反应前后元素种类不变
C. 生成物中无单质 D. 参加反应的单质和化合物两物质的分子个数比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体的溶解度曲线如图所示,据图回答:

(1)30℃时,丙的溶解度是________;
(2)50℃时,在100g水中放入50g乙物质,充分搅拌后所得溶液的溶质质量分数为________。(计算结果保留至0.1%);
(3)若将20℃时甲、乙、丙三种物质的饱和溶液升温至40℃(不考虑水的蒸发),可析出晶体的是________;
(4)将50℃时甲、乙、丙三种物质的饱和溶液均降温至10℃,所得溶液的溶质质量分数从大到小的顺序是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中常见的五种物质,其中 D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称干冰.①、②、③、④的反应类型分别是复分解反应、分解反应、化合反应和置换反应.图中“一”表示两端物质间能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去.
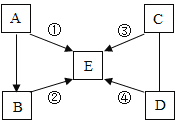
请回答下列问题:
(1)写出下列物质的化学式:
D_________ E_________
(2)写出下列反应的化学方程式:
①____________________ ④___________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146 mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表
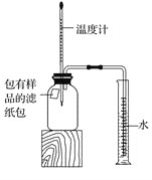
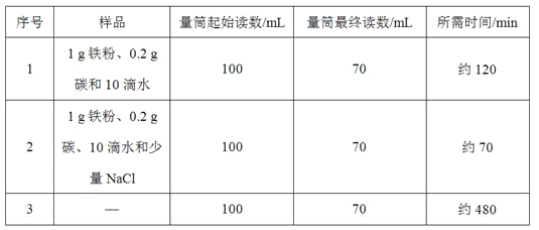
(1)实验①和②说明NaCl可以____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是______。
(4)已知碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成___。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是___(小数点后保留1位)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是奥运火炬“祥云”的用料示意图,
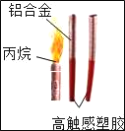
(1)属于有机高分子材料的是_____
(2)用铝合金比用铁制材料的优点是_____(答一点)
(3)燃料用丙烷(C3H8)为什么说体现了“绿色奥运”的理念精神_____
(4)采集奥林匹克圣火的唯一方式,是在奥林匹克的赫拉神庙前通过太阳光集中在凹面镜的中央,引燃圣火.此过程中最关键的燃烧条件是_____.
(5)北京奥运会火﹣炬能在每小时65公里的强风和每小时50毫米雨量的情况下保持燃烧.但要实现奥运圣火登顶珠峰,还需要解决最关键的燃烧条件是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应关系的是
A. 向等质量、等质量分数的稀硫酸中加入足量的镁、铝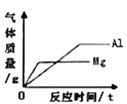
B. 向一定量稀硫酸和硫酸钠的混合液中滴加氯化钡溶液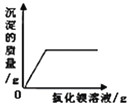
C. 向一定量的氢氧化钠溶液中滴加pH=2的稀硫酸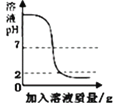
D. 等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应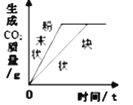
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
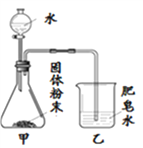
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式符合题意且书写正确的是( )
A. 不能用铁制容器配制波尔多液:2Fe+3CuSO4═Fe2(SO4)3+3Cu
B. 用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2![]() 2CO2
2CO2
C. 验证Fe和Zn的金属活动性:Zn+FeCl2═ZnCl2+Fe
D. 铁丝在氧气中燃烧:4Fe+3O2![]() 2Fe2O3
2Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com