


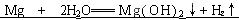


科目:初中化学 来源:不详 题型:实验题
| 步骤 | 实验操作 | 实验现象 | 推断(或结论) |
| (1) | 取废液放入试管观察 | | 废液中肯定不含FeCl3 |
| (2) | 用广泛pH试纸测定废液的pH | 测定结果:pH=3 | |
| (3) | 向废液中滴入足量 溶液 | 有白色沉淀出现 | 有硫酸或硫酸钠 |
| (4) | 向上述过滤所得的滤液中滴加AgNO3溶液 | 无明显反应现象 | |
| 废液成分的可能组合(写出溶质的化学式) | ①_____________________ ②H2SO4、HNO3 ③_____________________ | ||
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 预期现象与结论 |
| | _________________,说明老师取了CaCO3 |
| | _________________,说明老师取了CaCl2 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
| 实验操作 | 实验现象 | 实验结论 |
| ① 取该溶液少许于试管中,向其中滴加几滴 溶液 | 溶液中有白色沉淀生成 | 猜想①成立 |
| ② 用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟比色卡对照 | 溶液pH小于7 | 猜想④成立 |
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取该溶液少许于试管中, | | 猜想③成立,该反应的化学方程式为 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 | ① 溶液颜色__________; ② 不断搅拌溶液至溶液颜色恰好变成_____色为止。 | 酸和碱发生了中和反应,该反应属四种基本反应类型中的______反应。 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.用食盐水可以检验硬水和软水 | B.用加热蒸干的方法鉴别纯水和含杂质的水 |
| C.用pH试纸鉴别稀盐酸和氯化钠溶液 | D.用带火星的木条鉴别氧气和空气 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com