
分析 根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数,计算出硫酸(溶质)的质量,然后计算出溶液的质量分数.
解答 解:(1)根据质量守恒定律,产生氢气的质量为:20g+200g-219.8g=0.2g.故答案为:0.2.
(2)设黄铜样品中锌的质量为x,参加反应的硫酸的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.2g
$\frac{65}{2}$=$\frac{x}{0.2g}$ 解得:x=6.5g,$\frac{98}{2}$=$\frac{y}{o.2g}$,解得:y=9.8g.
黄铜样品中铜的质量分数为:$\frac{20g-6.5g}{20g}$×100%=67.5%;
$\frac{9.8g}{200g}$×100%=4.9%.
答:黄铜样品中铜的质量分数为67.5%,所用稀硫酸的溶质质量分数为4.9%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:初中化学 来源: 题型:推断题
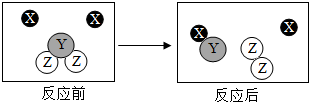 走进化学变化的微观世界,有利于进一步认识化学变化.如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:
走进化学变化的微观世界,有利于进一步认识化学变化.如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
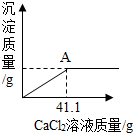 某化学课外活动兴趣小组的同学,多某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl2溶液(实验中产生的沉淀与加入CaCl2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计).试求:
某化学课外活动兴趣小组的同学,多某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl2溶液(实验中产生的沉淀与加入CaCl2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计).试求:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
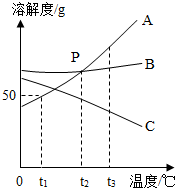 A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题:
A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用两个相同型号的塑料瓶各收集一瓶氧气和二氧化碳,再分别注入等量的水,旋紧瓶盖,振荡,通过观察塑料瓶变瘪的程度,比较氧气和二氧化碳在水中溶解度性的强弱 | |
| B. | 用等体积等质量分数的双氧水和不同质量的二氧化锰混合,测定收集相同体积氧气所需要的时间,探究催化剂用量对反应速率的影响 | |
| C. | 取等体积不同地区的两种天然水,分别加入不同体积的同种肥皂水,振荡.观察产生泡沫的多少,比较两种天然水中Ca2+、Mg2+含量的高低 | |
| D. | 在相同规格的烧杯中分别加入等体积的热水和冷水,分别在其中加一滴红墨水,比较红墨水在水中的扩散速率,探究温度对分子运动速率的影响 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 马来酸属于氧化物 | |
| B. | 马来酸由三种元素组成 | |
| C. | 马来酸中碳元素的质量分数最大 | |
| D. | 10%的马来酸溶液中氧元素的质量分数约为5.52% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
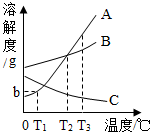 如图为A,B,C三种固体物质在水中的溶解度曲线,据此回答下列问题:
如图为A,B,C三种固体物质在水中的溶解度曲线,据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com