现将15.9g碳酸钠粉末(杂质不溶于水,也不参加反应)放入一定量的稀盐酸中,恰好完全反应,反应后得到溶质质量分数为11%的溶液106.4g.试计算:
(1)反应后溶液中溶质的质量;
(2)反应前稀盐酸中溶质的质量分数.
【答案】
分析:(1)根据溶质质量=溶液质量×溶质质量分数计算即可;
(2)根据碳酸钠与盐酸反应的化学方程式和(1)中计算出的反应后溶液中溶质NaCl的质量,即可计算出参与反应的HCl的质量、生成二氧化碳的质量、参与反应的Na
2CO
3的质量.然后根据溶质质量分数公式计算即可.
解答:解:(1)反应后溶液中溶质的质量=106.4g×11%=11.7g.
(2)设参与反应的HCl的质量为x,生成二氧化碳的质量为y,参与反应的Na
2CO
3的质量为z,
2HCl+Na
2CO
3=2NaCl+H
2O+CO
2↑
73 106 117 44
x z 11.7g y
∴
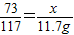
,
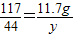
,
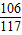
=
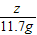
解之得:x=7.3g,y=4.4g,z=10.6g,
反应前稀盐酸溶液的质量为:106.4g+4.4g-10.6g=100.2g,
反应前稀盐酸中溶质的质量分数为:
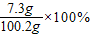
≈7.3%.
答:(1)反应后溶液中溶质的质量为11.7g;
(2)反应前稀盐酸中溶质的质量分数为7.3%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

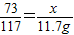 ,
,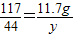 ,
,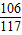 =
=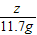
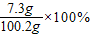 ≈7.3%.
≈7.3%.
