
【题目】物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?小刘、小李按下面的步骤进行探究:
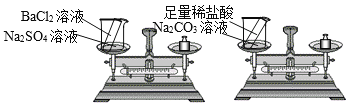
(1)提出假设:物质发生化学变化前后总质量不变。
(2)设计并进行实验:小刘设计的实验装置和选用药品如A所示,小李设计的实验装置和选用药品如B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
①这两个实验所发生的化学反应方程式为:
小刘的实验:_____
小李的实验:_____
②实验结论:
小刘认为:在化学反应中,生成物的总质量与反应物的总质量相等;
小李认为:在化学反应中,生成物总质量与反应物总质量不相等。
③你认为_______的结论正确,导致另一个实验结论错误的原因是:_____
④请从原子的角度分析你认为正确的结论的原因:_____
⑤使用上述实验装置,请你选择另外两种药品进行实验达到实验目的,这两种药品分别可以是_____和_____(填化学式)[注:以上四种药品均不能再用]。
【答案】BaCl2+Na2SO4=BaSO4↓+2NaCl Na2CO3+2HCl=2NaCl+H2O+CO2↑ 小刘 反应后生成的气体逸散到空气中去了 在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变 NaCl AgNO3
【解析】
①氯化钡和硫酸钠相互交换成分生成硫酸钡沉淀和氯化钠;碳酸钠和稀盐酸反应生成氯化钠和水和二氧化碳;书写化学方程式分别为:BaCl2+Na2SO4=BaSO4↓+2NaCl,Na2CO3+2HCl=2NaCl+H2O+CO2↑
③小刘的结论是正确的,因为在质量守恒定律中,反应物的总质量等于生成物的总质量,小李的实验漏掉生成物气体的质量。
④从原子的角度解释质量守恒定律,是因为反应前后原子的种类,数目,质量都不改变。
⑤选择药品验证质量守恒定律时,两种物质要能发生化学反应,且最好不生成气体物质,若有气体生成或参加的反应则应在密闭容器中进行,故可以选NaCl、AgNO3。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:
【题目】某兴趣小组对工业炼铁的相关知识进行了深入研究。
(知识回顾)工业炼铁的主要原料是铁矿石、焦炭、石灰石和空气,下列相关知识的归纳,正确的是_____。
A 工业炼铁得到的是纯铁
B CO还原氧化铁的反应属于置换反应
C 焦炭燃烧放热,提高炉温,并转化成CO
D 炼铁高炉排放的废气对空气无污染
(提出问题)该小组同学发现甲烷的性质与氢气、一氧化碳有很多相似之处。氢气、一氧化碳具有还原性,那么甲烷有没有还原性呢?
(查阅资料)1 无水硫酸铜是白色固体,吸收水分后变为蓝色。
2 铁的氧化物与稀硫酸反应时无气体生成
(实验探究)为探究上述问题,设计如下装置并进行实验。

(1)实验开始时先通一段时间甲烷的目的是_____________________。
(2)加热一段时间后,观察到A中硬质玻璃管中的固体粉末由红色全部变成黑色,取少量黑色粉末于试管中,加入适量稀盐酸,观察到________(填实验现象),说明有铁生成;B中白色固体变蓝,说明有_____生成;C中澄清石灰水变浑浊,说明有二氧化碳生成。
(结论)甲烷有还原性。若生成的黑色粉末全部是铁,甲烷还原氧化铁的化学方程式为__________________________。
(反思质疑)查阅资料得知:酒精灯加热时达不到高温,生成物中可能混有铁的其他氧化物FexOy.为探究甲烷与氧化铁反应后所得黑色粉末的成分,继续进行如下实验:
(1)探究黑色粉末中单质铁的质量分数:
①将如图各装置按照一定顺序连接,接口顺序是a→_____→_____→d(填序号)。

②检查装置气密性,称取7.2g黑色粉末 放入烧瓶中,向分液漏斗中加入稀硫酸。打开分液漏斗活塞,逐滴加入稀硫酸至无气泡产生,通过测量量筒内水的体积得出氢气质量为0.05g。计算黑色粉末中单质铁的质量分数。_______________(写出计算过程,结果保留到0.1%)
(2)确定黑色粉末中FexOy的化学式:
检查如图装置的气密性,另称取上述黑色粉末7.2g放入硬质玻璃管中,加热至完全反应,称得硬质玻璃管内剩余固体为5.6g,经检验全都是铁。若原黑色粉末中铁的氧化物只有一种,则FexOy的化学式为_____。从环保角度分析,如图装置存在的明显缺陷是_____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从化学反应![]() 中,得到的信息中叙述错误的是
中,得到的信息中叙述错误的是
A. 反应物是铁和氧气,生成物是四氧化三铁
B. 3份Fe跟2份O2反应,生成1份Fe3O4
C. 每168份质量的Fe跟64份质量的O2完全反应,能生成232份质量的Fe3O4
D. 在这个反应中,铁、氧气、四氧化三铁的质量之比为168:64:232
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是不含结晶水的a、b、c 三种物质的溶解度曲线,下列说法正确的是 ( )

A.t2℃时,将50g a 物质加入到50g 水中充分搅拌,得到100g a的饱和溶液
B.用等质量的a、b、c 三种固体配制成t2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液 > b溶液 > a溶液
C.将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是: b > a = c
D.将t2℃时a、b 两种物质的饱和溶液降温到t1℃时,析出晶体的质量: a > b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究一:气体的制取
实验室中进行实验需要制取少量的乙炔气体,小婷同学对制取乙炔的方法进行了探究。请你参与她探究过程并回答有关问题。
【查阅资料】小婷同学首先查阅了相关资料,获得了如下信息:
①乙炔(C2H2)是一种无色、无味、无嗅的气体,比空气轻,微溶于水,易燃烧。
②(A)天然气在电炉中高温下反应可生成乙炔:2CH4高温 C2H2+3H2
(B)固体碳化钙(CaC2)与水反应可生成乙炔:CaC2+2H2O=Ca(OH)2+C2H2↑
【选择装置】
(1)实验室应选择制取乙炔气体的反应原理你选择 上面 的是______(填“A”或“B”),选择该反应的理由是_________________。
(2)实验室中有以下两套气体的发生装置(下图)。

制取乙炔应选择的装置是___________(填“甲”或“乙”)。你选择此装置的理由是___________。
(3)若用下图装置收集乙炔气体,气体应该从______(a或b) 进入。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下:
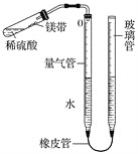
①取一段镁带样品,准确称得其质量为0.030 g;
②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器;
③_________________________;
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞;
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置;
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应;
⑦待冷却至室温后,再次记录量气管中液面位置;
⑧算出量气管中增加的气体体积为23.96 mL;
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式:____________________。
(2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。
(3)操作③是_________________________。
(4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。
(5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
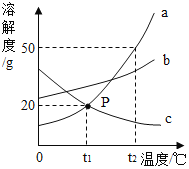
A. P点表示t1℃时,a、c饱和溶液中溶质质量相等
B. t2℃时,将30ga物质加入到50g水中充分搅拌,得到80ga的饱和溶液
C. t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
D. 将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对教材中“测定空气里氧气含量”的实验(见图Ⅰ)进行了大胆改进,设计图Ⅱ(选用容积为40mL的18×180mm的试管作反应容器)实验方案进行。请你对比分析下面图Ⅰ、图Ⅱ实验,回答下列有关问题:
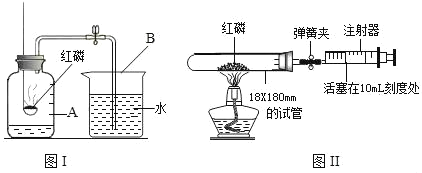
(1)指出实验中A、B仪器的名称:A_____、B_____红磷燃烧的文字(符号)表达式为_____。
(2)图Ⅱ实验的操作步骤如下:①点燃酒精灯。②撤去酒精灯,待试管冷却后松开弹簧夹。③将足量红磷平装入试管中,将20mL的注射器活塞置于10mL刻度处,并按图Ⅱ中所示的连接方式固定好,再将弹簧夹紧橡皮管。④读取注射器活塞的数据。你认为正确的实验操作顺序是_____(填序号)。
(3)图Ⅱ实验中,理论上注射器活塞将从10mL刻度处慢慢前移到约为_____ mL刻度处才停止。但是实验前小组同学忘记夹紧弹簧夹,则活塞会_____运动,最后停留在_____mL刻度处。若按图Ⅱ方案进行实验,小组的同学实验时可能出现的后果是_____。
(4)若实验时使用的红磷过多对实验结果影响是_____(填“偏大、偏小、不变”)。对照图Ⅰ实验,你认为图Ⅱ实验的可取之处是_____。(回答一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图:
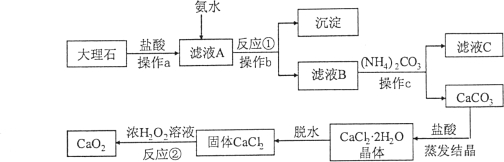
(1)操作a、b、c的名称都是 。
(2)操作a的目的是 。
(3)从滤液C中可回收的副产品的化学式为 。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(6)在该生产过程中,用110kg大理石制得了72Kg的过氧化钙。如果不考虑过程中的损耗,可计算出大理石中CaCO3的质量分数为 。(结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com