
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).分析 根据氯化钡和硫酸钠会生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡会生成溶于酸的碳酸钡沉淀等知识进行分析.
解答 解:(1)将固体溶解于水,硫酸钠会与氯化钡反应生成硫酸钡沉淀,硫酸钡不溶于盐酸;碳酸钠会与氯化钡反应生成碳酸钡沉淀,碳酸钡沉淀会溶于盐酸,据图可以看出,加入盐酸,沉淀减少,然后不变,且有气体生成,故一定含有碳酸钡沉淀和硫酸钡沉淀,所以混合物中一定含有碳酸钠、硫酸钠和氯化钡;
(2)碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑;
(3)因为硫酸钠会与氯化钡反应生成硫酸钡沉淀和氯化钠;碳酸钠会与氯化钡反应生成碳酸钡沉淀和氯化钠;碳酸钡沉淀会溶于盐酸生成二氧化碳和氯化钡、水,盐酸时过量的,故在C点时,所得溶液中的溶质一定有氯化钡、氯化氢.
故答案为:(1)BaCl2、Na2SO4、Na2CO3;
(2)BaCO3+2HCl=BaCl2+H2O+CO2↑;
(3)HCl、BaCl2.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 混合物:矿泉水、纯净的空气 | B. | 酸:盐酸、硫酸铜 | ||
| C. | 氧化物:水、氢氧化钠 | D. | 有机物:葡萄糖、二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲实验试管口向下倾斜可防止氢气逸出 | |
| B. | 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 | |
| C. | 甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸 | |
| D. | 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 ”代表的离子Fe3+(填离子符号).
”代表的离子Fe3+(填离子符号). ”的是C(填选项).
”的是C(填选项).查看答案和解析>>
科目:初中化学 来源: 题型:多选题
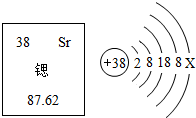 锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )
锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )| A. | Sr为金属元素 | B. | 乙图中X≡3 | ||
| C. | 锶原子的质量为87.62g | D. | 锶原子的质子数是38 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com