
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算铁和氯化亚铁的质量,进而求算对应的质量分数.
解答 解:根据质量守恒定律可得,生成的氢气的质量为10g+100g-109.8g=0.2g
设铁的质量为x,生成的氯化亚铁的质量为y
Fe+2HCl═FeCl2+H2↑
56 127 2
x y 0.2g
$\frac{56}{x}$=$\frac{127}{y}$=$\frac{2}{0.2g}$
x=5.6g
y=12.7g
铁粉样品中铁的纯度为$\frac{5.6g}{10g}$×100%=56.0%
反应后所得溶液中溶质的质量分数为$\frac{12.7g}{5.6g+100g-0.2g}$×100%≈12.0%
答:(1)铁粉样品中铁的纯度是56.0%;(2)反应后所得溶液中溶质的质量分数是12.0%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实验前检查仪器和用品是否齐全 | |
| B. | 实验过程中互相配合,共同完成实验 | |
| C. | 如实记录实验现象和数据 | |
| D. | 对无腐蚀性的固体药品,可直接用手去拿 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
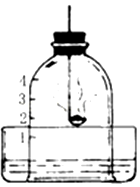 实验探究题.如图所示,为测定空气中的氧气含量,同学们将钟罩放入盛水的水槽中,并将钟罩内水面以上的容积分为5等份.在燃烧匙内盛有红磷.将红磷用酒精灯点燃后,立即插入钟罩内.回答下列问题:
实验探究题.如图所示,为测定空气中的氧气含量,同学们将钟罩放入盛水的水槽中,并将钟罩内水面以上的容积分为5等份.在燃烧匙内盛有红磷.将红磷用酒精灯点燃后,立即插入钟罩内.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
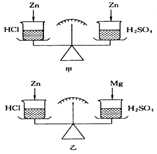 如图所示,在托盘天平两边各放一只烧杯,调至平衡.往右边烧杯里注入一定量的稀硫酸,左边烧杯里注入相同质量的盐酸.
如图所示,在托盘天平两边各放一只烧杯,调至平衡.往右边烧杯里注入一定量的稀硫酸,左边烧杯里注入相同质量的盐酸.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
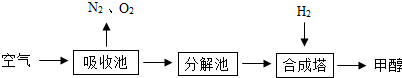
| A. | 该流程可以减轻碳的排放,缓解大气温室效应 | |
| B. | 合成塔中发生反应的化学方程式是:CO2+3H2$?_{高温高压}^{催化剂}$CH3OH+H2O | |
| C. | 吸收池中发生的是化合反应,分解池中发生的是分解反应,合成塔中发生的是置换反应 | |
| D. | 吸收池中是盛饱和碳酸钾溶液,分解池中的是碳酸氢钾溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 除杂试剂(足量) | 操作方法 | |
| A | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| B | K2CO3(KCl) | 稀盐酸 | 加入稀盐酸、蒸发、结晶 |
| C | FeSO4(CuSO4) | 铁粉 | 加入铁粉并过滤 |
| D | Zn(Fe) | 稀硫酸 | 加入稀硫酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com