

分析 ①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳不能使石蕊变红;要证明二氧化碳密度比空气大,且不改变装置,可分别在Y型管管口和底部放置湿润紫色石蕊滤纸条进行实验,观察现象.
②根据二氧化碳的性质分析.
③证明CO2不能燃烧,可以使燃着的木条熄灭.
④根据制取二氧化碳时可以带出少量水蒸汽以及二氧化碳后被生石灰吸收分析.
解答 解:①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,而二氧化碳不能使石蕊变红;证明二氧化碳的密度大于空气,可以将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部.
②二氧化碳与水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,所以澄清石灰水先变浑浊,过量的二氧化碳又可使石灰水变澄清;
③证明CO2不能燃烧,可以将燃着的木条伸入D集气瓶中,木条会熄灭.
④制取二氧化碳时可以带出少量水蒸汽,二氧化碳与水蒸气反应生成碳酸,也可能使干燥的紫色是蕊试纸变色,所以在A、B装置处添加E装置可以使实验更严密,E装置中无水硫酸铜的作用是吸收水分;如果无水硫酸铜用生石灰替代,会发生CaO+H2O=Ca(OH)2和CO2+Ca(OH)2=CaCO3↓+H2O反应,将二氧化碳吸收.
故答案为:①二氧化碳与水反应;二氧化碳不能使干燥紫色石蕊试纸变红色;将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部;
②石蕊变红色,澄清石灰水先变浑浊(后变澄清);
③燃着的木条伸入D集气瓶中,熄灭;
④吸收水分;CaO+H2O=Ca(OH)2;CO2+Ca(OH)2=CaCO3↓+H2O.
点评 本题考查了学生二氧化碳的性质分析解题和设计实验的能力,能训练学生的思维和应用知识解答问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我市某校研究性学习小组在老师指导下,对人类呼吸作用是否产生二氧化碳进行探究.现请你一同参与:
我市某校研究性学习小组在老师指导下,对人类呼吸作用是否产生二氧化碳进行探究.现请你一同参与:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图以稀硫酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同.结合此图回答下列问题:
如图以稀硫酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同.结合此图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
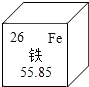 酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )| A. | 中子数为26 | B. | 核外电子数为26 | ||
| C. | 相对原子质量为55.85g | D. | 地壳中含量最高的金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 化学反应 | 化学方程式 | 简答 |
| 二氧化碳通入灼热的碳 | 2CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | 反应类型化合反应 |
| 硫在空气中燃烧 | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | 反应现象产生淡蓝色火焰,产生一种具有刺激性气味的气体 |
| 水在通电条件下的反应 | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | 各生成物的质量比为1:8 |
| 氯酸钾与二氧化锰共热 | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | 在本反应中,二氧化锰起催化作用 |
| 在硫酸铜溶液中滴入氢氧化钠溶液 | 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ | 生成物的沉淀是蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
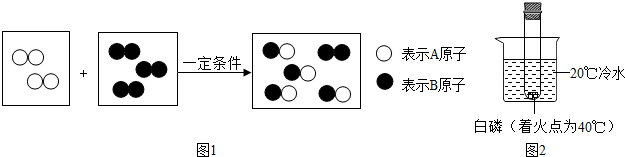
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com