【答案】
分析:(1)从金属的用途反应其性质的角度和合金的性质的角度分析;
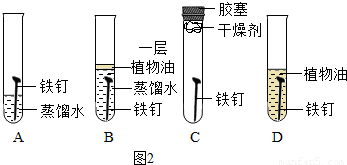
(2)根据铁生锈的条件进行分析,铁在有水和氧气并存时易生锈;
(3)从化学方程式书写角度分析;
(4)根据铁、锌的金属活动性强弱以及化学方程式的计算进行分析;
(5)利用金属的活动性强弱关系,判断金属铁加入硝酸铜和硝酸银的混合溶液中发生反应的情况;由于反应情况与所加入铁粉的量密切相关,因此通过固体的成分的检验或滤液成分的检验,对所得固体或所得溶液的组成进行判断.
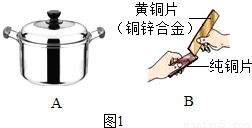
解答:解:(1)金属的用途反应其性质,饭锅主要是利用了金属的导热性;黄铜片是铜的合金,硬度比铜大,当黄铜片(铜锌合金)与铜片互相刻划时,在铜片的表面可留下划痕.故答案为:导热性;黄铜比纯铜的硬度大;
(2)A、此试管中铁钉与水和氧气同时接触,易生锈,故A正确;
B、此试管中铁只与水接触,不易生锈,故B错误;
C、此试管中铁只与氧气接触,不易生锈,故C错误;
D、此试管中铁与水和氧气都不接触,不易生锈,故D错误.
故选A.
(3)一氧化碳与赤铁矿冶炼生铁的反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,反应条件是高温.故答案为:Fe
2O
3+3CO
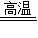
2Fe+3CO
2;
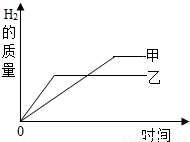
(4)A、把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都没有剩余,说明金属全部参加反应,据图可以知道,在相同的时间内,乙产生的氢气质量比甲多,故乙是锌,甲是铁,故A正确;
B、
Fe+H
2SO
4=FeSO
4+H
2↑
56 98
设56份质量的锌消耗硫酸的质量为x,
Zn+H
2SO
4=ZnSO
4+H
2↑
65 98
56 x
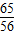
=
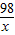
解得x≈84,
故相同质量的锌和铁,铁消耗稀硫酸的质量大,故B正确;
C、反应后金属都没有剩余,说明金属全部参加反应,故消耗的铁盒锌的质量相等,故C错误;
D、根据B选项计算可知道,充分反应后,铁消耗的硫酸的质量大于锌消耗的硫酸的质量,有可能是铁反应的硫酸恰好完全反应,故D错误;
故选AB;
(3)滤出的固体滴加稀盐酸没有有气泡产生,说明所得固体中不含铁粉;加入的铁粉完全反应,则反得固体中一定含有金属活动性最差的金属银;如果完全置换混合溶液中的银离子后,还有铁粉,则铁粉继续与硝酸铜反应而置换出铜,所以所得固体也可能为银和铜的混合物;
滤液成分的判断:滤液中一定有不参加反应的Zn(NO
3)
2和生成的Fe(NO
3)
2①一定量的铁粉可能完全置换出银,溶液中一定有Cu(NO
3)
2、Fe(NO
3)
2和Zn(NO
3)
2,故选B;
也可能置换出部分银,则溶液中一定有:AgNO
3、Cu(NO
3)
2、Fe(NO
3)
2和Zn(NO
3)
2,故选D;
②一定量的铁可能完全置换出银,接着置换铜:铜若完全被置换,则溶液中一定有:Fe(NO
3)
2和Zn(NO
3)
2,故选A;
若铜部分被置换,则溶液中一定有:Cu(NO
3)
2、Fe(NO
3)
2和Zn(NO
3)
2,故选C.
点评:本题重点考查了金属的性质用途、合金的性质、化学方程式书写、金属与酸的反应情况以及实验操作过程的推断,难度较大.

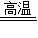 2Fe+3CO2;
2Fe+3CO2;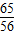 =
=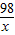


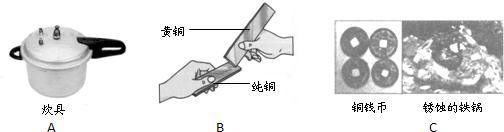
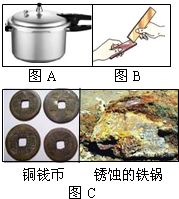 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.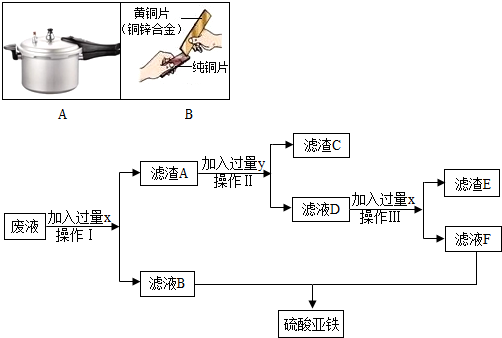
 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛. 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.