
【题目】人体注射葡萄糖溶液可以补充能量,葡萄糖(C6H12O6)在体内经缓慢氧化生成二氧化碳和水,释放出能量。若1 000克5%葡萄糖注射液中的葡萄糖完全氧化,计算:
(1)理论上至少消耗O2多少克?
(2)多少升空气中含有这些质量的氧气?
(相对原子质量:H:1、C:12、O:16、O2密度按1.43克/升计,计算结果取整数)
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】中国地质调查局5月18日宣布,在南海北部神狐海域进行的可燃冰试开采获得成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家,可燃冰是天然气和水在低温、高压条件下形成的白色或灰色晶体,燃烧产生的二氧化硫比石油、煤低两个数量级,但同等条件下燃烧产生的能量比石油、煤多数十倍.目前,我国已探明在南海存储的可燃冰相当于650亿吨石油,按我国当前能源消耗水平,可供我国使用130年. 请根据以上信息回答下列问题:
(1)写出可燃冰的一条性质;
(2)可燃冰降压可分离出甲烷,甲烷燃烧的化学方程式为;
(3)可燃冰作为未来一种潜力很大的能源,其突出的优点为(任写一条);
(4)可燃冰若开采不慎,会导致甲烷气体大量泄漏,对环境造成的影响是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学方程式解释下列现象:
(1)小颖同学在探究二氧化碳性质时,将二氧化碳气体通入紫色石蕊溶液中,石蕊溶液很快变红色,原因是_________。
(2)石灰浆抹墙,墙壁坚硬、洁白,是因为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)现有指定化合价的几种元素:![]() ,请选择元素,写出符合要求的化合物的化学式:
,请选择元素,写出符合要求的化合物的化学式:
(1)一种难溶于水的碱____;
(2)一种酸____;
(3)一种复合肥料____;
(4)原子个数比为1∶1的氧化物____;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关金属材料的说法正确的是( )
A.金属材料都是银白色的固体
B.铁制品在潮湿的空气中易生锈
C.高炉炼铁的原理是用焦炭还原赤铁矿
D.为了减缓铁制品的锈蚀洗净其表面的油膜
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食用下列方法处理过的食品或药品,不会危及人体健康的是
A. 用工业酒精配制的饮用酒B. 用工业明胶制作药品胶囊
C. 用甲醛浸泡的海鲜D. 用干冰冷藏的食品
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是对铁的锈蚀条件的探究。课本实验中,铁生锈所需要时间较长,某实验小组设计了如图所示的改进实验。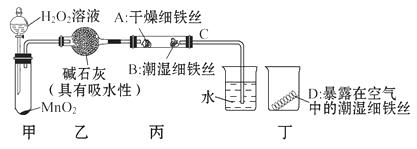
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是。
(2)反应开始后,甲装置中的反应现象: , MnO2的作用:。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮,A、B处实验现象对比,可得出铁生锈与有关;B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“单原子催化”入选年度化学化工领域“十大科研成果”。下列关于催化剂的认识正确的是( )
A.催化剂只能加快其它物质的反应速率
B.催化剂在化学反应前后,其物理性质和化学性质都不变
C.任何化学反应都需要催化剂
D.催化剂在化学反应前后,其质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属与我们生活关系密切。
(1)铁
①下列物品所使用的主要材料属于合金的是____(填标号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
②生铁和钢是常用的合金,生铁的含碳量比钢的含碳量__________(填“高”或“低”)。 生铁冶炼的主要原理是利用一氧化碳与氧化铁反应,反应的化学方程式为__________________________________。
③生活中常用铁锅做炊具,利用了铁的___________性。
④颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式____________________________________。
⑤铁制品锈蚀的过程,实际上是铁与空气中的________和________ 等发生化学反应的过程;回收废钢铁的目的是_______________________ (写一点)。
(2)铜
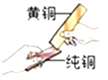
①黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明合金的硬度比组成中的纯金属要_________(填“大”、“小”)。
②黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。通过流程如下图的方法处理黄铜渣可得到硫酸锌(杂质不溶于水、不参与反应)。
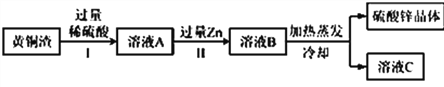
资料:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
Ⅱ中生成金属单质的化学反应方程式为_____________________________________。该流程最终得到的硫酸锌中锌元素质量_____(填“<”、“=”、“>”)黄铜中锌元素质量。
(3)铝
①铝块能制成铝箔是利用了铝的_________性。
②铝比铁活泼,但铝比铁耐腐蚀的原因是______________________________________。
③由铝粉与氧化铁组成的铝热剂在高温下反应,生成另一种氧化物和另一种金属单质,常用于焊接铁轨,试写出该反应的化学方程式:___________________。
(4)锌
锌等金属可以用于生产纽扣电池,下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
①该反应后锌元素的化合价为___________。
②将该反应中的反应物进行简单分类,则下面横线上的物质是(填化学式):
纯净物:单质:_____________金属氧化物:_____________
③该电池中通常还加入石墨粉,是因为石墨具有良好的__________性。
④废旧电池不能随意丢弃,由于电池种类不同,应______________回收。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com