

分析 (1)碳酸钙能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳或碳酸钠反应生成碳酸钙,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来;
(2)根据物质的循环利用分析;
(3)根据氢氧化钙的溶解性分析;
(4)根据题中信息二氧化碳过量会生成碳酸氢钙以及碳酸氢钙微热分解的性质分析;
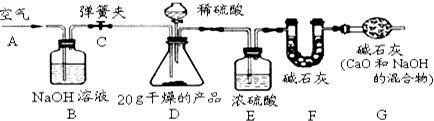
(5)根据流程图及实验原理,要测定碳酸钙的质量分数,可测定生成的二氧化碳的质量,可利用F装置吸收二氧化碳,在吸收之前需除去二氧化碳中的水分及空气中的二氧化碳,因此要利用除去二氧化碳的空气将生成的二氧化碳全部排到F装置中.
【总结反思】根据二氧化碳的溶解性解答.
解答 解:(1)①碳酸钙高温分解生成氧化钙和二氧化碳,②生成的氧化钙与水反应生成氢氧化钙,故B为二氧化碳,C为氧化钙,生成的D为氢氧化钙,③氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,④氢氧化钙能与碳酸钠发生复分解反应生成碳酸钙和氢氧化钠,生成的碳酸钙不溶于水,可以通过过滤的方法从溶液中分离出来,同时得到副产品氢氧化钠;
(2)流程①、②、③的③是将碳酸钙分解生成的二氧化碳加以利用,节约了原料;
(3)澄清石灰水中氢氧化钙浓度太小,生产效率很低.悬浊液中含有氢氧化钙较多,得到的轻质碳酸钙多;
(4)由题中信息二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2;碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2═CaCO3↓+H2O+CO2↑可知将碳酸氢钙转化成碳酸钙可以采用微热的方法;
(6)①为增大反应物的接触面积,加快反应速率,让反应物充分反应,可将产品研成粉末;
②根据流程图装置分析,要通过测定生成的二氧化碳的质量计算碳酸钙的含量,则需将生成的二氧化碳用除去二氧化碳的空气全部排出,因此B装置的作用是除去空气中的二氧化碳;E装置是除去生成的二氧化碳中的水,F装置是吸收生成的二氧化碳,G装置的作用是防止空气中的二氧化碳进入F装置;
③若没有E装置,生成的二氧化碳气体中含有水分而使二氧化碳的质量增大,则测定的CaCO3的质量分数会偏大.
称量F的质量,得前后两次质量差为8.7g,故生成的二氧化碳的质量为8.7g
设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 8.7g
$\frac{100}{x}$=$\frac{44}{8.7g}$
x=19.77g
故碳酸钙的质量分数为:$\frac{19.77g}{20g}$×100%=98.86%;
【总结反思】利用碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,通过所设计的方案测量完全反应产生气体二氧化碳的质量,然后根据反应的化学方程式计算参加反应碳酸钙的质量,求得牙膏中碳酸钙的质量分数;二氧化碳能溶于水,而会使测得的二氧化碳体积偏小.
故答案为:(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,过滤,NaOH;
(2)二氧化碳得到充分利用,节约原料;
(3)悬浊液,澄清石灰水中氢氧化钙浓度太小,生产效率很低;
(4)微热;
(5)①增大接触面积,充分反应;
②除去空气中的二氧化碳,防止空气中的二氧化碳进入F装置;
③偏大,98.86%;
【总结反思】二氧化碳能溶于水.
点评 本题考查了碳酸钙、氧化钙和氢氧化钙的相互转化以及化学方程式的书写、根据化学方程式计算、判断物质的组成等方面的问题.


科目:初中化学 来源: 题型:解答题
| 试管编号 | 1 | 2 | 3 | |
| 材料名称 | 无 | 苹果 | 土豆 | |
| 实验现象 | 反应速率 | 很慢 | 稍快 | 较快 |
| 产生气泡 | 很少 | 比1中多 | 较多 | |
| 复燃情况 | 不复燃 | 复燃 | 很快复燃 | |
| 实验结论 | 苹果、土豆对过氧化氢的分解均有催化作用,但催化效果不同或土豆催化效果较好 | |||
| 实验编号 | 1 | 2 | 3 |
| 过氧化氢溶液浓度 | 5% | 15% | 30% |
| 所用时间(秒) | 205 | 25 | 3 |
| 实验结论 | 浓度越大,反应速率越快 | ||
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 提倡使用太阳能 | B. | 开展植树造林 | ||
| C. | 工厂废气经处理达标后排放 | D. | 开未达到环保标准的汽车上路 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 氧 | 钙 | 铝 | 氯 | ||||
| Si | Ag | Fe | Na |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ② | B. | ④⑥⑦ | C. | ⑦ | D. | ③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com