
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
分析 (1)欲知碳酸钠属于哪一类,须熟知酸、碱、盐的概念,欲知它的俗名叫纯碱的原因,须知它的水溶液的性质;
(2)根据氯化铵和氢氧化钙反应生成氨气、水和氯化钙,实验室制取氨气的反应物是固体,反应条件是加热,氨气极易溶于水,密度比空气密度小进行分析;
(3)①根据第一次加入稀盐酸充分反应后,生成的二氧化碳逸出,因此生成的二氧化碳质量应该是参加反应的物质质量之和,减去反应后物质质量之和进行分析;
②根据其产品包装袋上注明:碳酸钠≥96%,故该产品中碳酸钠的质量分数只要≥96%,就是合格.所以应先求出该产品中碳酸钠的质量分数,再通过比较,就可知是否合格进行分析.
解答 解:(1)酸指电离时产生的阳离子全部都是氢离子的化合物,碱指电离时产生的阴离子全部都是氢氧根离子的化合物,盐指电离时生成金属阳离子(或NH4)和酸根离子的化合物,所以碳酸钠(Na2CO3)属于盐,它的俗名叫纯碱是因为碳酸钠的水溶液显碱性;
(2)①消石灰的化学式为Ca(OH)2,氯化铵和氢氧化钙反应生成氨气、水和氯化钙,化学方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
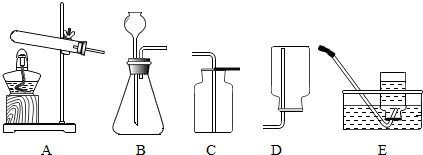
②由题意可知,实验室一般用氯化铵和消石灰共热来制备少量的氨气,所以要用A装置来进行加热,又因为NH3的密度比空气小,且易溶于水,所以用D向下排空气法收集,所以制取和收集氨气可用下图中的A和D装置;
(3)①第一次加入稀盐酸充分反应后,生成的二氧化碳逸出,因此生成的二氧化碳质量应该是参加反应的物质质量之和,减去反应后物质质量之和.第一次加入稀盐酸是100g÷4=25g,烧杯及所盛纯碱样品的总质量为158.0g,因此烧杯及参加反应物质的质量之和为158g+25g=183g,充分反应后烧杯及所盛物质的总质量为181.2g,所以生成的二氧化碳的质量为183g-181.2g=1.8g;
②共生成二氧化碳的质量为158g+100g-253.6g=4.4g
设样品中Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g
$\frac{106}{x}$=$\frac{44}{4.4g}$
x=10.6g
样品中Na2CO3的质量分数为:$\frac{10.6g}{11g}$×100%=96.4%>96%,
所以产品中Na2CO3的质量分数合格.
故答案为:(1)盐,碳酸钠的水溶液显碱性;
(2)Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,A,D;
(3)①1.8g;
②所以产品中碳酸钠的质量分数合格.
点评 本题覆盖的知识面较广,它要求学生要熟记酸碱盐的概念,对常见物质的化学式能正确书写,并且能理解充分反应的概念,还要熟练掌握质量分数的计算方法,才能正确答题.


科目:初中化学 来源: 题型:解答题
 如表提供了A、B两种物质的溶解度数据,读取信息后回答:
如表提供了A、B两种物质的溶解度数据,读取信息后回答:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 物质A | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| 物质B | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室通常用如图装置模拟冶炼铁,请回答问题:
实验室通常用如图装置模拟冶炼铁,请回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com