
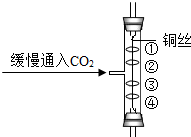
 如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是( )
如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是( )| A. | ①变红,③不变红 | B. | ④比①先变红,②、③不变红 | ||
| C. | ①、④变红,②、③不变红 | D. | ④变红,③不变红 |
科目:初中化学 来源: 题型:解答题
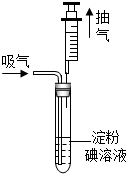 某地规定工业排放的废气中S02的含量不得超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中S02的含量,测试装置如图所示.
某地规定工业排放的废气中S02的含量不得超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中S02的含量,测试装置如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
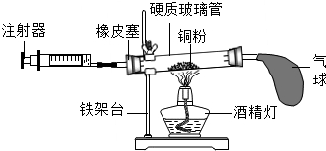
| A. | 铜粉必须足量,否则测得氧气含量的结果偏小 | |
| B. | 实验结束后冷却到室温才能读数 | |
| C. | 气球的作用是调节气压,使氧气完全反应 | |
| D. | 在正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的$\frac{1}{5}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
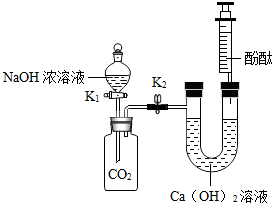 某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取滤液样品于试管中,加入足量的盐酸; | 若有气泡冒出,且红色消失 | 原废液中的溶质为: Na2CO3和NaOH; |
| ②另取滤液样品于试管中,加入Na2CO3溶液. | 若有白色沉淀出现,红色不消失 | 原废液中的溶质为: Ca(OH)2和NaOH. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com