
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 证明含有K2SO3 |
| 3 | 向B试管中,加入氯化钡溶液,再加入足量的稀盐酸; | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
分析 根据SO2与水结合生成弱酸性亚硫酸(H2SO3),反应生成的化学方程式解答;
(1)根据酸雨是pH小于5.6的降雨进行解答;
(2)根据氧化钙与二氧化硫和氧气反应生成硫酸钙进行解答;
(3)根据氢氧化钠的质量,利用化学方程式即可求出二氧化硫的质量进行解答;
(4)【提出猜想】根据反应后混合溶液中盐的成分可能是亚硫酸钾或硫酸钾或二者的混合物进行解答;
【实验与探究】3、根据硫酸钾会和氯化钡反应生成硫酸钡沉淀、亚硫酸钾和氯化钡溶液反应生成亚硫酸钡沉淀以及稀盐酸和亚硫酸钡反应生成二氧化硫气体进行解答;
(5)根据Na2SO3与盐酸反应生成氯化钠、水和二氧化硫进行解答;
解答 解:
SO2与水结合生成弱酸性亚硫酸(H2SO3),反应生成的化学方程式为:SO2+H2O═H2SO3;
(1)酸雨是pH小于5.6的降雨;故填:5.6;
(2)氧化钙与二氧化硫和氧气反应生成硫酸钙,化学方程式为:2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4;故填:2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4;
(3)设吸收二氧化硫的质量为x.
SO2+2NaOH═Na2SO3+H2O
80 80
x 80g×10%
$\frac{80}{x}=\frac{80}{80g×20%}$
x=16g
(4)【提出猜想】反应后混合溶液中盐的成分可能是亚硫酸钾或硫酸钾或二者的混合物;故填:K2SO4;
【实验与探究】3、硫酸钾会和氯化钡反应生成硫酸钡沉淀、亚硫酸钾和氯化钡溶液反应生成亚硫酸钡沉淀,稀盐酸和亚硫酸钡反应生成二氧化硫气体,所以向B试管中,加入氯化钡溶液,再加入足量稀盐酸,现象:先有白色沉淀产生,后有气泡产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立.故填:氯化钡溶液,稀盐酸;
(5)K2SO3与盐酸反应生成氯化钾、水和二氧化硫,化学方程式为:K2SO3+2HCl=2KCl+SO2↑+H2O;故填:K2SO3+2HCl=2KCl+SO2↑+H2O;
答案:
(1)5.6;
(2)2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4;
(3)理论上可吸收二氧化硫16g;
(4)K2SO4,
| 骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 证明含有K2SO3 |
| 3 | 向B试管中,加入 氯化钡溶液,再加入足量的 稀盐酸; | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
点评 此题是对有关酸雨知识的考查,解题的关键是对相关溶液的酸碱性判断和测定方法的掌握,属基础性知识考查题.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:选择题
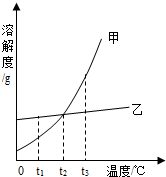 如图是甲、乙两种固体物质的溶解度曲线图.下列说法中正确的是( )
如图是甲、乙两种固体物质的溶解度曲线图.下列说法中正确的是( )| A. | t2℃时,甲、乙两种物质溶液的溶质质量分数一定相等 | |
| B. | t3℃时,将甲、乙的饱和溶液都蒸发掉 10g水,析出甲的晶体质量比析出乙的晶体质量大 | |
| C. | 若甲中混有少量乙,可采用蒸发结晶的方法提纯甲 | |
| D. | t1℃时,把甲的不饱和溶液变为饱和溶液,溶剂质量一定不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 取0.5gCaCO3粉末于试管中,加入过量稀盐酸,充分振荡,粉末消失且有气泡产生 | |
| B. | 取0.5gCaCO3粉末于试管中,加入过量硫酸,充分振荡后,产生少许气泡,粉末未消失 | |
| C. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴入酚酞试液,立即变红 | |
| D. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴加10%NaOH溶液,无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 细铁丝在氧气中燃烧火星四射 | |
| B. | 镁在空气中燃烧生成白色固体 | |
| C. | 红磷在空气中燃烧冒出大量的白烟 | |
| D. | 硫在空气中燃烧发出明亮的蓝紫色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | |
| A | FeSO4溶液 | CuSO4 | Zn |
| B | Fe | Cu | H2SO4 |
| C | 稀盐酸 | KCl | KOH溶液 |
| D | CaCO3 | CaCl2 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com