
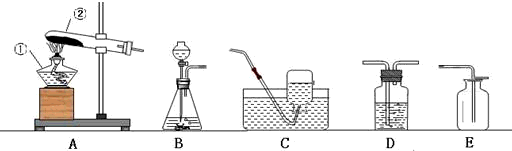
 CaCl2+2NH3↑+2H2O.
CaCl2+2NH3↑+2H2O. CaCl2+2NH3↑+2H2O;A.
CaCl2+2NH3↑+2H2O;A.

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
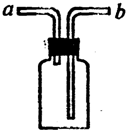
 过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,在加热的条件下,它能分解生成氧气和水.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气出使,加热到80℃时就有较多氧气产生.小凯用如图所示装置及上述方法制得氧气,用带火星的木条直接在试管口检验,结果木条不能复燃.他经过思考找出了实验失败的原因,并对装置进行了改进,结果成功地完成了实验.
过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,在加热的条件下,它能分解生成氧气和水.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气出使,加热到80℃时就有较多氧气产生.小凯用如图所示装置及上述方法制得氧气,用带火星的木条直接在试管口检验,结果木条不能复燃.他经过思考找出了实验失败的原因,并对装置进行了改进,结果成功地完成了实验.查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
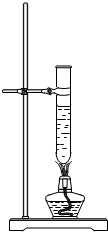
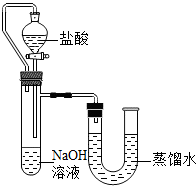 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应.查看答案和解析>>
科目:初中化学 来源:2012年广东省广州市增城市中考化学一模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com