
| A. | 双氧水中加入二氧化锰,溶液变蓝 | |
| B. | 氧化铝放入稀盐酸中,产生大量气泡 | |
| C. | 在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 | |
| D. | 铵盐与碱溶液混合加热,产生的气体使湿润的蓝色石蕊试纸变红 |
分析 A、根据双氧水分解制取氧气的实验现象进行分析判断.
B、根据酸的化学性质,进行分析判断.
C、根据碱的化学性质,进行分析判断.
D、根据铵盐的检验方法进行分析判断.
解答 解:A、双氧水中加入二氧化锰,二氧化锰作催化剂,反应速率加快,反应后溶液不会变蓝,故选项说法错误.
B、氧化铝放入稀盐酸中,氧化铝与稀盐酸反应生成氯化铝和水,不会产生大量气泡,故选项说法错误.
C、在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀,会观察到产生蓝色絮状沉淀,故选项说法正确.
D、铵盐与碱溶液混合加热,产生的气体使湿润的红色石蕊试纸变蓝,不能使蓝色石蕊试纸变红,故选项说法错误.
故选:C.
点评 本题难度不大,掌握碱的化学性质、酸的化学性质、铵盐的检验方法是正确解答本题的关键.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:初中化学 来源: 题型:解答题
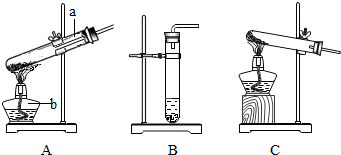
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
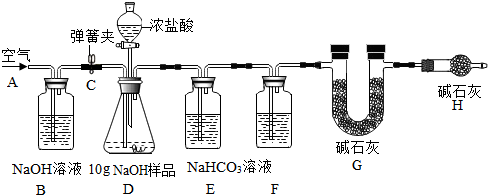
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
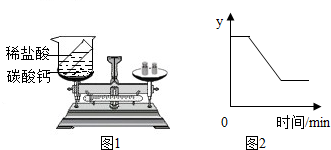 根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.
根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
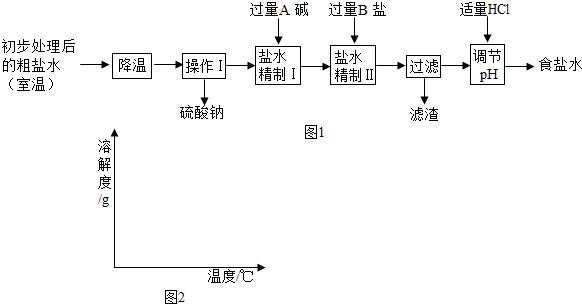
| 实验操作 | 实验现象 | 实验结论 |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是二氧化碳的知识网络图(反应条件已略).请用化学符号表示以下内容.
如图是二氧化碳的知识网络图(反应条件已略).请用化学符号表示以下内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com