
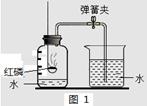
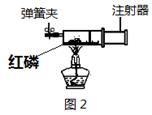
| 实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g | |
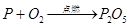 ②BC ③检验装置气密性 没有白烟进入空气,环保(不会有空气溢出,测量精确/直接读数,测量精确) 二、①时间(收集一定体积氧气所需时间)②小, ③验证氧化铜质量不变,验证氧化铜化学性质不变,比较氧化铜和二氧化锰的催化效果;
②BC ③检验装置气密性 没有白烟进入空气,环保(不会有空气溢出,测量精确/直接读数,测量精确) 二、①时间(收集一定体积氧气所需时间)②小, ③验证氧化铜质量不变,验证氧化铜化学性质不变,比较氧化铜和二氧化锰的催化效果;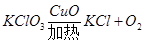 三、①分子不断运动;左侧酚酞变红;没有刺激性气味进入空气,环保(药品用量少);②蓝紫色;
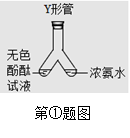
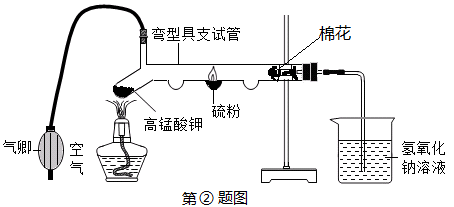
三、①分子不断运动;左侧酚酞变红;没有刺激性气味进入空气,环保(药品用量少);②蓝紫色;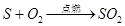 ;对照硫在空气和氧气中燃烧(一套装置完成2个相关实验);吸收二氧化硫,
;对照硫在空气和氧气中燃烧(一套装置完成2个相关实验);吸收二氧化硫,

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:初中化学 来源:不详 题型:实验题
| | 实验步骤 | 实验现象 | 实验结论 |
| 步骤一 | 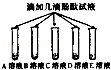 | B,C溶液呈现红色 A,D,E溶液颜色无明显变化 | B,C溶液显 性 |
| 步骤二 | 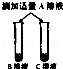 | B,C溶液红色均消失, 且C溶液中产生大量气泡 | 可确定B为 溶液;A与C的反应通常 不用作实验室制取气体的 原因是 |
| 步骤三 | 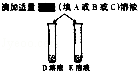 | E中无明显现象, D中的现象为 | 确定E为氯化钠溶液, 则D溶液与所加试剂发生反应的化学方程式为 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
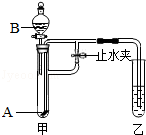
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| | 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
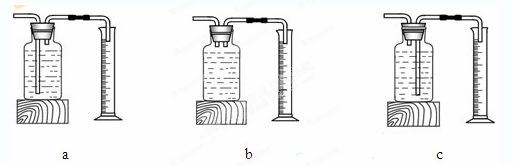
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 浓度 时间/min 催化剂 | 30%H2O2 溶液 | 15%H2O2 溶液 | 5%H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| | 实验操作 | 实验现象 | 实验结论或总结 | |
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但反应速率 。 反应的化学方程式为: 。 | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | | |
| 实验三 | | | 二氧化锰能加快过氧化氢的分解 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com