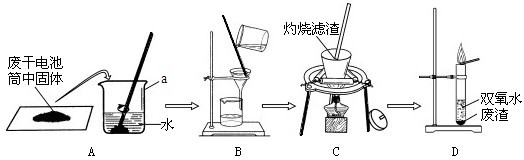
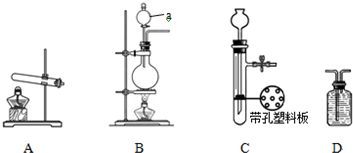
解:(1)a 是支持和固定试管用的仪器,叫铁架台,b是加入液体药品用的仪器,没有盖和活塞,叫长径漏斗.
(2)A装置是加热固体制气体的,试管口处有一团棉花,应是加热高锰酸钾制氧气,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,故方程式为2KMnO
4
K
2MnO
4+MnO
2+O
2↑.
(3)B装置是固体与液体在常温下制气体的装置,制二氧化碳时选用的药品为石灰石和稀盐酸,反应原理是碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O.
(4)在装置B的基础上,增加了隔离铜网和止水夹后可通过气压变化控制反应物之间的接触和分离,故该装置的优点是能够控制反应的发生和停止.
(5)①块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2,说明盐酸过量,加入碳酸钠溶液后,碳酸钠先中和盐酸后才能与氯化钙反应,故AB段是碳酸钠与盐酸反应,BC段是碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,方程式为Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl.
②碳酸钠溶液呈碱性,过量的碳酸钠使溶液的碱性增强,CD段加入的碳酸钠溶液已过量,不再参加反应,只是使液体碱性增强,所以CD段的pH上升.
故答案为:
(1)铁架台;长颈漏斗;
(2)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(3)CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O;
(4)能够控制反应的发生和停止;
(5)①Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl;②碳酸钠溶液呈碱性,过量的碳酸钠使溶液的碱性增强(写出“碳酸钠溶液呈碱性”即给分).
分析:(1)根据仪器的形状、结构、用途回答.
(2)根据气体发生装置的选择依据、实验室制氧气的原理、装置中试管口处的棉花回答.
(3)根据气体发生装置的选择依据、实验室制二氧化碳的原理回答.
(4)根据在装置B的基础上,增加了隔离铜网和止水夹后可通过气压变化控制反应物之间的接触和分离回答.
(5)①根据制二氧化碳反应结束后残留物的成分,以及碳酸钠的化学性质回答,注意碳酸钠先与盐酸反应后才能再与氯化钙反应.
②根据碳酸钠的水溶液呈碱性回答.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、装置气密性检查方法、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.



 K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑. K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案