
| 106 |
| x |
| 73 |
| y |
| 117 |
| z |
| 44 |
| 8.8g |
| 14.6g |
| 36% |
| 21.3g | ||
|


科目:初中化学 来源: 题型:
| A、K2SO4 Ba(OH)2 KCl |
| B、Cu(NO3)2 NaCl KNO3 |
| C、Na2CO3 KNO3 NH4Cl |
| D、MgSO4 NaNO3 KCl |
查看答案和解析>>
科目:初中化学 来源: 题型:
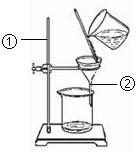 如图为某学生进行粗盐提纯实验时过滤操作的示意图.试回答:
如图为某学生进行粗盐提纯实验时过滤操作的示意图.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | KClO3 | 其他物质质量 | 待测数据 |
| ① | 1.2g | ||
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com