
 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快.| 编号 | 20%的稀硫酸各20mL | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1mL | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1mL | 1g | 3分01秒 |
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中, 加入20mL 20%的稀硫酸 | 产生氢气的速率较快与铜单质有关 | |
| ② |
分析 【猜想假设】根据硫酸溶液中本身含有硫酸根离子解答;
【实验证明】步骤一:根据检查装置气密性的方法解答;
步骤二:根据长颈漏斗的使用注意事项解答;
实验三:根据实验要求分析解答;
根据锌与稀硫酸反应生成的是硫酸锌和氢气解答;
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关解答;
【反思质疑】根据锌比铜活泼,锌会与硫酸铜反应生成铜解答;
【继续探究】根据实验要求设计实验进行对比.
解答 解:【猜想假设】丙同学认为乙的猜想不科学,理由是硫酸溶液中本身含有硫酸根离子;
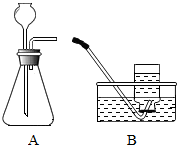
【实验证明】步骤一:检查图A所示装置气密性,采用的方法是:连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好;
步骤二:长颈漏斗下端要插入液面以下,目的是保证气体不从漏斗处逸出;
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125ml)所需的时间(如表),等到反应开始产生气体时立刻收集;
锌与稀硫酸反应生成的是硫酸锌和氢气,反应的化学方程式是:Zn+H2SO4═ZnSO4+H2↑;
【得出结论】:硫酸中混有硫酸铜溶液时,产生氢气的速率加快与有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰(对比实验或控制具体变量);
【反思质疑】锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是在金属活动性顺序中,锌排在铜的前面,能与硫酸铜反应生成硫酸锌和铜;
【继续探究】
取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸,再取1g锌粒于锥形瓶,加入少量铜,再加入20mL 20%的稀硫酸,②中反应速率比①快,产生氢气的速率较快与铜单质有关.
故答案为:【猜想假设】硫酸溶液中本身含有硫酸根离子;
【实验验证】
步骤一:连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好(合理即可).
步骤二:保证气体不从漏斗处逸出
实验三:等到反应开始产生气体时立刻收集
Zn+H2SO4=ZnSO4+H2↑;
【得出结论】铜离子;加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰;
【反思质疑】锌会与硫酸铜反应生成铜;
【继续探究】
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | ②中反应速率比①快 | ||
| ② | 取1g锌粒于锥形瓶,加入少量铜,再加入20mL 20%的稀硫酸 |
点评 本题考查了探究溶质质量分数不同的硫酸与锌反应速率的实验,完成此题,可以依据题干提供的信息结合物质的性质进行.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:选择题
| 物质 | 番茄 | 肥皂水 | 牛奶 | 酱油 |
| pH | 4.0-4.4 | 9.5-10.5 | 6.3-6.6 | 4.0-5.0 |
| A. | 番茄 | B. | 肥皂水 | C. | 牛奶 | D. | 酱油 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
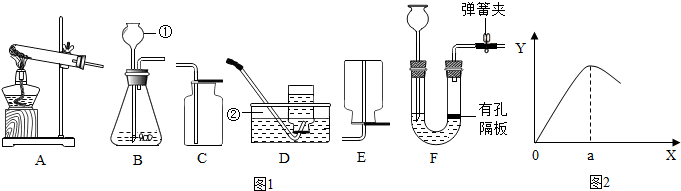
 黄铜是一种常见的合金材料,其主要成分为Cu、Zn,还含有少量不与酸反应的成分,现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生H2的质量和硫酸溶液体积的关系如图所示,充分反应后溶液中剩余固体的质量为27g.
黄铜是一种常见的合金材料,其主要成分为Cu、Zn,还含有少量不与酸反应的成分,现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生H2的质量和硫酸溶液体积的关系如图所示,充分反应后溶液中剩余固体的质量为27g.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
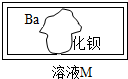 某化学兴趣小组在完成酸、碱、盐的化学性质实验时,做了如下实验:向碳酸钠溶液中加入一瓶标签破损的溶液M(如图),有白色沉淀产生,过滤后得到澄清滤液,同学们对该实验进行了如下探究.
某化学兴趣小组在完成酸、碱、盐的化学性质实验时,做了如下实验:向碳酸钠溶液中加入一瓶标签破损的溶液M(如图),有白色沉淀产生,过滤后得到澄清滤液,同学们对该实验进行了如下探究.| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴入酚酞试液 | 溶液变红 | 猜想①正确 |
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | “猜想一”不成立 |
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入Na2CO3溶液. | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| 若A中没有沉淀,B中产生白色沉淀 | “猜想二”成立 | |
| 若A、B中都没有沉淀产生 | “猜想三”成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com