已知CO与Fe
2O
3作用生成Fe的反应是分步进行的,反应中铁的氧化物中氧元素质量分数逐渐降低.
| 序号 |
化学反应 |
| ① |
Fe3O4+COFeO+CO2 |
| ② |
3Fe2O3+CO2Fe3O4+CO2 |
| ③ |
FeO+COFe+CO2 |
(1)上述三个反应发生的先后顺序是
②①③
②①③
.
(2)某同学取2.4g纯净的Fe
2O
3与CO反应一段时间后,对剩余固体的成分展开探究.
【实验过程】
|
实验内容 |
实验现象 |
| 实验一 |
冷却后,称量剩余固体 |
剩余固体质量为1.76g |
| 实验二 |
取一部分剩余固体,用磁铁靠近 |
部分粉末能被磁铁吸引 |
【分析与结论】
小明认为该黑色粉末中一定含有铁;小军认为还需要再设计一个实验才能证明产物中含有铁,他的理由是
Fe3O4具有磁性也能被磁铁吸引
Fe3O4具有磁性也能被磁铁吸引
;
小军设计的实验可能是(写出方法与现象)
取一部分剩余的固体于小烧杯中,加入适量稀盐酸,有气泡产生,溶液变成浅绿色
取一部分剩余的固体于小烧杯中,加入适量稀盐酸,有气泡产生,溶液变成浅绿色
;
【拓展延伸】
化学生产中往往会以某一种元素的转化来计算“反应的转化率”,其公式如下:
反应转化率=
×100%;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为
88.9%
88.9%
.(结果用百分数表示,保留一位小数).



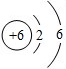
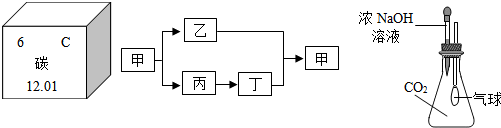
 FeO+CO2
FeO+CO2 2Fe3O4+CO2
2Fe3O4+CO2 Fe+CO2
Fe+CO2 ;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为________.(结果用百分数表示,保留一位小数).
;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为________.(结果用百分数表示,保留一位小数). FeO+CO2
FeO+CO2 2Fe3O4+CO2
2Fe3O4+CO2 Fe+CO2
Fe+CO2 ;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为 .(结果用百分数表示,保留一位小数).
;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为 .(结果用百分数表示,保留一位小数).