解:(1)t
2℃时,A的溶解度为50g或50g/100g水;
(2)在t
1℃到t
2℃之间,B、C的溶解度曲线没有交点,故不能配制成溶质质量分数相同的饱和溶液;
(3)由饱和溶液中溶质的质量分数计算式可知,溶解度越大,则饱和溶液中溶质的质量分数越大;因为t
2℃时A、B、C三种物质的溶解度大小是:A>B>C,所以t
2℃时A、B、C的饱和溶液的质量分数是A>B>C,降温后A和B都析出晶体,仍然是饱和溶液,又因为t
1℃时,B的溶解度大于A的,所以t
1℃时,B的饱和溶液的质量分数大于A物质的饱和溶液的质量分数;由于C物质降温后变为不饱和溶质质量分数不变,所以要比较C物质在t
2℃时的溶解度与t
1℃时A、B的溶解度大小,即溶液中溶质的质量分数大小,通过图表可知:B>A>C;
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:称量固体药品用的托盘天平(带砝码盒),溶解需要的烧杯,取药品的药匙,搅拌、加速溶解的玻璃棒,还需要量取液体的量筒和定容用的胶头滴管;
故答案为:(1)50g或50g/100g水;
(2)不能;
(3)B>A>C;
(4)BCFG.
分析:(1)根据溶解度曲线可知物质在某温度下的溶解度;
(2)同一温度下物质的溶解度相等则溶质的质量分数相等;
(3)据三种溶质的由溶解度曲线及饱和溶液中溶质的质量分数的计算式

×100%分析解答;
(4)根据配制一定溶质质量分数的溶液所需仪器进行解答.
点评:本题容易出错的地方是将t
2℃时三种物质的饱和溶液降温至t
1℃时,溶液中溶质的质量分数的大小比较,明确饱和溶液中溶质的质量分数计算方法,并能结合物质的溶解度随温度的变化情况才能正确解答,在分析解答时要结合所学知识细心分析解决问题.

 根据如图A、B、C三种固体的溶解度曲线回答:
根据如图A、B、C三种固体的溶解度曲线回答: ×100%分析解答;
×100%分析解答;

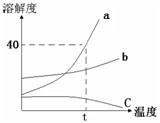 23、根据如图a、b、c三种物质的溶解度曲线,回答下列问题.
23、根据如图a、b、c三种物质的溶解度曲线,回答下列问题. (2012?虹口区二模)根据如图A、B、C三种固体的溶解度曲线回答:
(2012?虹口区二模)根据如图A、B、C三种固体的溶解度曲线回答: 根据如图A、B、C三种固体的溶解度曲线回答:
根据如图A、B、C三种固体的溶解度曲线回答: