
| 编号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 15 | 12 | 12 |
| 加入氯化钙溶液的质量/g | 100 | 100 | 150 |
| 反应后生成沉淀的质量/g | 10 | 10 | 10 |
分析 根据数据可以分析得知,第二组数据是恰好完全反应.根据生成10g碳酸钙和对应的化学方程式求算碳酸钠和氯化钙以及生成的氯化钠的质量,进而求算对应的质量分数.
解答 解:由图表数据分析可知,第2次是碳酸钠和氯化钙恰好完全反应生成10g碳酸钙.
设12g样品中碳酸钠的质量为x,参加反应的氯化钙的质量为y,生成的氯化钠的质量为z
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x y 10g z
$\frac{106}{x}$=$\frac{111}{y}$=$\frac{100}{10g}$=$\frac{117}{z}$
x=10.6g
y=11.1g
z=11.7g
样品中氯化钠的质量分数为$\frac{12g-10.6g}{12g}$×100%≈11.7%;
加入氯化钙溶液的溶质质量分数为$\frac{11.1g}{100g}$×100%=11.1%;
恰好完全反应时,反应后所得溶液中氯化钠的质量分数$\frac{12g-10.6g+11.7g}{12g+100g-10g}$×100%≈12.8%
答:(1)样品中氯化钠的质量分数为11.7%;
(2)加入氯化钙溶液的溶质质量分数为11.1%;
(3)恰好完全反应时,反应后所得溶液中氯化钠的质量分数12.8%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4NaClNa2CO3CaCl2 | B. | HCl NaOHCuSO4 MgSO4 | ||
| C. | NaNO3HCl CaCl2KOH | D. | Na2CO3 K2SO4 BaCl2HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 我国稀土金属储量世界第一,可以任意开发利用 | |
| B. | 研发秸秆综合利用技术,避免因直接焚烧而造成大气污染 | |
| C. | 利用二氧化碳捕捉技术,减少因二氧化碳引起的“温室效应” | |
| D. | 改造城市排水管网,实现雨水和生活污水的分流处理与利用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
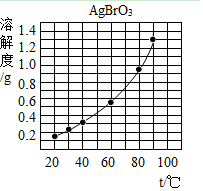 溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )| A. | 升高温度溴酸银的溶解度增大 | |
| B. | 40℃时溴酸银易溶于水 | |
| C. | 90℃时溴酸银溶液的溶质质量分数一定小于1.3% | |
| D. | 溴酸银可用降温结晶的方法从溶液中析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com