考点:碱的化学性质,二氧化碳的实验室制法,二氧化碳的物理性质,二氧化碳的化学性质,二氧化碳的用途,一氧化碳的化学性质,金属资源的保护,化石燃料及其综合利用
专题:化学与能源,碳单质与含碳化合物的性质与用途,金属与金属材料,常见的盐 化学肥料
分析:(1)石灰水中的溶质是氢氧化钙,盛放石灰水的试剂瓶,长期露置在空气中,能与空气中的二氧化碳反应生成碳酸钙沉淀和水,据此进行分析解答;
(2)从金属的防腐、回收再利用及开采和寻找新的代替品这些方面去考虑;
(3)根据石油属于化石燃料,是不可再生能源进行解答;
(4)根据一氧化碳具有可燃性、毒性以及还原性,能和氧化铜反应进行解答;
(5)根据实验中观察到的现象结合物质的性质来分析,并利用性质来分析物质的用途来解答本题.
解答:解:(1)石灰水中的溶质是氢氧化钙,盛放石灰水的试剂瓶,长期露置在空气中,能与空气中的二氧化碳反应生成碳酸钙和水;碳酸钙是一种不溶于水的白色物质,故瓶中常形成一层白色薄膜;反应的化学方程式为:CO
2+Ca(OH)
2═CaCO
3↓+H
2O;故答案为:碳酸钙;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(2)解:①每年会有很多金属被腐蚀而浪费掉,所以要防止金属腐蚀;②充分回收再利用;③控制资源,集中开发,避免由于开发条件有限导致的共生金属被浪费的现象;④积极开发,寻找低价金属合金或复合材料代替高价金属的解决方案;故答案为:防止金属腐蚀;回收利用废旧金属;合理有效地开采矿物;
(3)石油加热时不同沸点的物质分别气化、冷凝、分离后可得到汽油、煤油等产品,是根据沸点的不同分离的属于物理变化,石油属于化石燃料,是不可再生能源;故填:物理;不可再生;
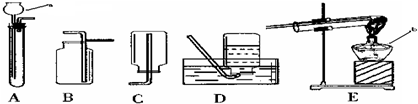
(4)①一氧化碳有毒,不能直接排放到空气中,因此要在装置图末端的导气管口放一盏燃着的酒精灯将一氧化碳燃烧除去,防止污染空气;故填:用点燃法去掉一氧化碳,防止污染空气;
②一氧化碳属于可燃性气体,不纯加热可能会发生爆炸,实验前要先通入一氧化碳,排净装置内的空气,防止加热时发生爆炸;故填:排净装置内的空气,防止加热时发生爆炸;
③一氧化碳具有还原性,能和氧化铜反应生成铜和二氧化碳,所以A处现象:黑色的氧化铜粉末变成红色,化学方程式为:CO+CuO
Cu+CO
2;故填:黑色的氧化铜粉末变成红色;CO+CuO
Cu+CO
2;
④实验先熄A处灯,等到试管冷却后再停止通CO,原因防止生成的铜被空气的中氧气氧化;故填:先熄A处灯;防止生成的铜被空气的中氧气氧化;
(5)①实验室制取二氧化碳,用大理石或石灰石与稀盐酸反应,它们的主要成分为碳酸钙,生成物有氯化钙、水和二氧化碳,方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;二氧化碳能溶于水,与水反应生成碳酸,不能用排水法收集,由于密度比空气大,可用向上排空气法收集;故填:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;向上排空气法;
②因沿烧杯内壁缓缓倾倒二氧化碳时,可观察到下面的蜡烛先熄灭,过一会上面的蜡烛再熄灭,故答案为:烧杯中的蜡烛下面的先熄灭,上面的后熄灭;
③由蜡烛熄灭可知二氧化碳不燃烧也不支持燃烧,由蜡烛熄灭的顺序可知下面的先熄灭,即二氧化碳由下到上充满烧杯中,则密度比空气的大,故答案为:二氧化碳的密度比空气大;一般情况下,二氧化碳既不能燃烧,也不能支持燃烧;
④因二氧化碳不燃烧也不支持燃烧,且密度比空气的大,可使可燃物与空气隔绝而起到灭火的作用,即可利用二氧化碳来灭火,故答案为:灭火.
点评:本题考查二氧化碳制取以及性质、一氧化碳还原氧化铁的原理、实验现象及操作注意事项,要根据已有的知识进行分析解答.




 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
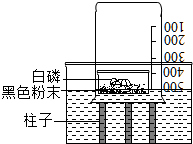 在按书本装置测定空气中氧气含量的实验时,当装置内的氧气低于一定含量时,红磷就不再与氧气反应,从而导致测量结果偏小.有老师对该实验进行了改进,装置如图所示,在一容器中倒入刚拆封的“暖宝宝”黑色粉末,再在上面放足量的白磷,迅速扣上烧杯,随后白磷自燃,利用这一装置可更准确地测定空气中氧气的体积分数.
在按书本装置测定空气中氧气含量的实验时,当装置内的氧气低于一定含量时,红磷就不再与氧气反应,从而导致测量结果偏小.有老师对该实验进行了改进,装置如图所示,在一容器中倒入刚拆封的“暖宝宝”黑色粉末,再在上面放足量的白磷,迅速扣上烧杯,随后白磷自燃,利用这一装置可更准确地测定空气中氧气的体积分数.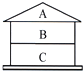 如图A、B、C三种物质,且上、下相邻的物质间均可发生反应.若B为CuO,A和C是不同种类的物质,且它们与B的反应属于不同的基本反应类型,写出相应的化学方程式,并分别指出所属的基本反应类型.
如图A、B、C三种物质,且上、下相邻的物质间均可发生反应.若B为CuO,A和C是不同种类的物质,且它们与B的反应属于不同的基本反应类型,写出相应的化学方程式,并分别指出所属的基本反应类型.