
| A. | +2 | B. | +3 | C. | -1 | D. | 2 |
科目:初中化学 来源: 题型:选择题
| A. | 二氧化硫 一氧化碳 二氧化氮 | B. | 二氧化碳 一氧化碳 氮气 | ||
| C. | 二氧化硫 二氧化碳 二氧化氮 | D. | 氮气 氧气 一氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
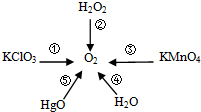 如图所示,很多物质分解可以产生氧气.
如图所示,很多物质分解可以产生氧气.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | HClO3 | B. | HClO | C. | HClO4 | D. | HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | 溶液 | 碱性强弱 | 食用油完全溶解时间 |
| 【1】 | 25°C,NaHCO3溶液15ml | 最弱 | 10S |
| 【2】 | 25°C,Na2CO3溶液15ml | 较弱 | 8S |
| 【3】 | 70°C,Na2CO3溶液15ml | 较强 | 4S |
| 【4】 | ? | 最强 | 2S |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com