

分析 (1)根据质量守恒定律,求得加入的稀硫酸溶液的质量;
(2)反应后所得溶液为硫酸钾溶液,根据氢氧化钾的质量求出硫酸钾的质量;
(3)通过计算相同质量的KOH消耗H2SO4比HCl多,得出结论.
解答 解:
(1)根据质量守恒定律和图示,求得加入的稀硫酸溶液的质量为87g-56g=31g;
(2)设反应后生成K2SO4的质量为y,
H2SO4 +2KOH=K2SO4 +H2O
112 174
56g×10% y
$\frac{112}{56g×10%}=\frac{174}{y}$
Y=8.7g
∴反应后所得溶液的溶质质量分数为$\frac{8.7g}{87g}×100%=10%$.
(3)设56g×10%氢氧化钾和所用稀硫酸、盐酸的质量分别为y、z
由:H2SO4 +2KOH=K2SO4 +H2O
HCl+KOH=KCl+H2O
可知关系式2KOH~H2SO4~2HCl
112 98 71
56g×10% y z
$\frac{112}{56g×10%}=\frac{98}{y}$,y=4.9g;
$\frac{112}{56g×10%}=\frac{71}{z}$,z=3.65g
也就是说中和同样多的碱,消耗的盐酸更少,所以相同质量的KOH消耗H2SO4比HCl多,当H2SO4与HCl相等时,HCl有余.
故答案为:
(1)31
(2)设反应后生成K2SO4的质量为y
H2SO4+2KOH=K2SO4+H2O
112 174
56g×10% y
$\frac{112}{56g×10%}=\frac{174}{y}$
Y=8.7g
∴反应后所得溶液的溶质质量分数为$\frac{8.7g}{87g}×100%=10%$.
(3)<盐酸有剩余
点评 本题考查了酸碱度的测定方法的评价,酸碱性与pH的关系以及酸碱中和反应的运用等,综合性较强,但难度不大,关键还是熟练掌握溶液酸碱性、酸碱度测定的方法及酸碱中和反应的原理.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温 度/℃ | 20 | 40 | 60 | 80 | |
| 溶解度/g | KNO3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 36.0 | 36.6 | 37.3 | 38.4 | |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 加入的试剂和操作 | 基本反应类型 |
| A | CuO(Cu) | 适量稀盐酸,过滤 | 复分解反应 |
| B | CaO(CaCO3) | 高温煅烧 | 分解反应 |
| C | Cu(NO3)2溶液(AgNO3) | 过量锌粉,过滤 | 置换反应 |
| D | CO2(CO) | 氧气,点燃 | 化合反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属的回收利用是保护金属资源的有效途径之一 | |
| B. | 炒完菜后应及时除掉锅底的水,这样可以防止铁锅生锈 | |
| C. | 铝在空气中易生成一层致密的氧化物保护膜,故铝制品性质不稳定 | |
| D. | 生铁和钢是含碳量不同的铁合金,其中生铁的含碳量大于钢的含碳量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
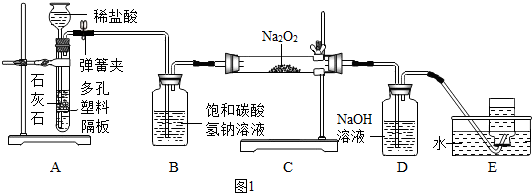
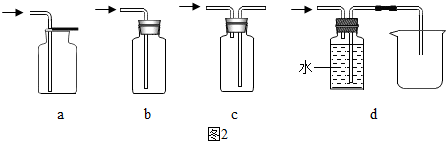
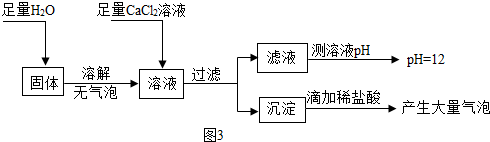
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳能用作灭火器 | |
| B. | 干冰能用于人工降雨 | |
| C. | 二氧化碳能用来生产汽水等碳酸饮料 | |
| D. | 二氧化碳用作气体肥料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com