Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼Ę²¢½ųŠŠĮĖČēĻĀŹµŃ飮
£Ø1£©¼××éĶ¬Ń§ÓĆČēĶ¼×°ÖĆÖĘČ”øÉŌļ“æ¾»µÄ¶žŃõ»ÆĢ¼ĘųĢ壮Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁŅĒĘ÷XµÄĆū³ĘŹĒ
³¤¾±Ā©¶·
³¤¾±Ā©¶·
£®ŹµŃéĒ°£¬¹Ų±Õ»īČū£¬ĻņXÖŠ¼ÓČėĖ®Ź¹XÖŠŅŗĆęøßÓŚŹŌ¹ÜÖŠµÄŅŗĆę£¬Ņ»¶ĪŹ±¼äŗóŅŗĆę±£³Ö²»±äĖµĆ÷
A×°ÖƵÄĘųĆÜŠŌĮ¼ŗĆ
A×°ÖƵÄĘųĆÜŠŌĮ¼ŗĆ
£®
¢ŚĪŖ³żČ„CO
2ÖŠ»ģÓŠµÄHClĘųĢ壬B×°ÖĆÖŠŹ¢·Å±„ŗĶNaHCO
3ČÜŅŗ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½
NaHCO3+HCl=NaCl+CO2ӟ+H2O
NaHCO3+HCl=NaCl+CO2ӟ+H2O
£®
¢ŪŅŖµĆµ½øÉŌļµÄCO
2£¬C×°ÖĆÓ¦Ź¢·Å
ÅØĮņĖį
ÅØĮņĖį
£ØĢīŹŌ¼ĮĆū³Ę£©£®
¢ÜĒėĖµĆ÷×°ÖĆB”¢CÖŠŹŌ¼Į²»Äܽ»»»µÄŌŅņ£ŗ
Čō½«ĘųĢåøÉŌļŗóŌŁĶعż±„ŗĶNaHCO3ČÜŅŗ£¬ŌņÓÖÓŠĖ®ÕōĘų“ų³ö
Čō½«ĘųĢåøÉŌļŗóŌŁĶعż±„ŗĶNaHCO3ČÜŅŗ£¬ŌņÓÖÓŠĖ®ÕōĘų“ų³ö
£®
£Ø2£©ŅŅ×éĶ¬Ń§Ī§ČĘCO»¹ŌCuO²śÉśµÄŗģÉ«¹ĢĢåŹĒ·ńŅ»¶ØŹĒCu½ųŠŠĢ½¾æ£ŗ
”¾²éŌÄ׏ĮĻ”æ
¢ŁCu
2O·ŪÄ©³ŹŗģÉ«£®ŌŚĖįŠŌČÜŅŗÖŠ£ŗCu
2O+H
2SO
4=Cu+CuSO
4+H
2O
¢ŚŌŚæÕĘųÖŠøßĪĀ×ĘÉÕŹ±£ŗCu
2OĪČ¶Ø£¬¶ųCuO½«·Ö½āÉś³ÉCu
2OŗĶO
2”¾Ģį³ö²ĀĻė”æ
²ĀĻė¢ń£ŗŗģÉ«¹ĢĢåŹĒCu£» ²ĀĻė¢ņ£ŗŗģÉ«¹ĢĢåŹĒCu
2O£» ²ĀĻė¢ó£ŗŗģÉ«¹ĢĢåŹĒ
Cu2OŗĶCuµÄ»ģŗĻĪļ
Cu2OŗĶCuµÄ»ģŗĻĪļ
£®
”¾ŹµŃéĢ½¾æ”æ
²½Öč¢ń£ŗŠ“³öÓÉCuÉś³ÉCu
2OµÄ»Æѧ·½³ĢŹ½ŹĒ
£®
²½Öč¢ņ£ŗŹż¾Ż·ÖĪö
£Ø1£©Č”Ņ»¶ØÖŹĮæµÄŗģÉ«¹ĢĢåa g£¬ŌŚæÕĘųÖŠøßĪĀ×ĘÉÕ£¬Ö±µ½ÖŹĮæ²»ŌŁ·¢Éśøı䣬³ĘĮæĖłµĆ¹ĢĢåÖŹĮæĪŖb g£®
¢ŁČōa=b£¬Ōņ²ĀĻė
II
II
³ÉĮ¢£»
¢ŚČōb£¾a£¬ŌņĖµĆ÷ŗģÉ«¹ĢĢåÖŠŅ»¶Øŗ¬ÓŠ
Cu
Cu
ĪļÖŹ£»
£Ø2£©ĮķȔɣĮæŗģÉ«¹ĢĢåĶ¶ČėĻ”ĮņĖįÖŠ£¬³ä·Ö·“Ó¦ŗóČÜŅŗ³ŹĄ¶É«£®øł¾Ż“ĖĻÖĻó£¬ĖµĆ÷“ĖŗģÉ«¹ĢĢåÖŠŗ¬ÓŠ
Cu2O
Cu2O
£¬Čē¹ū¹ĢĢå¼õÉŁ1.6gŌņŌ»ģŗĻĪļÖŠÓėĻ”ĮņĖį·¢Éś·“Ó¦µÄĪļÖŹÓŠ
2.88
2.88
g£®

 Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼Ę²¢½ųŠŠĮĖČēĻĀŹµŃ飮
Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼Ę²¢½ųŠŠĮĖČēĻĀŹµŃ飮


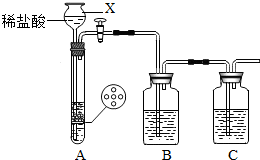 £Ø2012?³ē“ØĒųŅ»Ä££©Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼Ę²¢½ųŠŠĮĖČēĻĀŹµŃ飮
£Ø2012?³ē“ØĒųŅ»Ä££©Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼Ę²¢½ųŠŠĮĖČēĻĀŹµŃ飮
 Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘµÄŹµŃé×°ÖĆ£ØČēĶ¼£©£¬¼ČæÉÖĘČ”ĘųĢ壬ÓÖæÉÓĆÓŚŃéÖ¤ĪļÖŹŠŌÖŹ£®
Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘµÄŹµŃé×°ÖĆ£ØČēĶ¼£©£¬¼ČæÉÖĘČ”ĘųĢ壬ÓÖæÉÓĆÓŚŃéÖ¤ĪļÖŹŠŌÖŹ£®