
(1)反应物的浓度:
(2)反应物的接触面积:
科目:初中化学 来源: 题型:
| 我的假设 | 我验证假设的方案 | 预期现象 |
| (1) 反应物的浓度越大,反应速率越快 |
向两只相同的试管中加入相同质量的二氧化锰,再同时加入体积相同、浓度不同的过氧化氢溶液 |
过氧化氢浓度大的试管中产生的气泡多并且快 |
| (2) 温度越高、反应速率越快 |
向两只相同的试管中加入相同质量的二氧化锰,再同时加入体积相同、浓度相同的过氧化氢溶液,其中一只试管在酒精灯上加热 |
加热的试管中产生的气泡多并且快 |
| (3) 使用催化剂可以加快反应速率 |
向两只相同的试管中加入体积相同、浓度相同的过氧化氢溶液,其中一只试管中加入适量的二氧化锰 |
加入二氧化锰的试管中产生的气泡多并且快 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
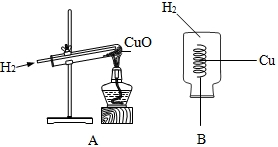
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com