
下列方法不能达到除杂的目的的是( )
选项 | 物质(括号内为杂质) | 方法 |
A | N2(O2) | 将混合气体通过灼热铜网 |
B | Fe粉(炭粉) | 加入足量稀H2SO4充分反应,过滤、洗涤、干燥 |
C | CaO(CaCO3) | 高温煅烧 |
D | FeCl2溶液(CuCl2) | 加入足量Fe粉,过滤 |
A. A B. B C. C D. D
B 【解析】A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,正确;B、Fe粉能与稀硫酸反应生成硫酸亚铁溶液和氢气,炭粉不与稀硫酸反应,会把原物质除去,不符合除杂原则,错误;C、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,正确;D、足量Fe粉能与CuCl2溶液反应生成氯化亚铁溶液和铜,再过... 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:初中化学 来源:吉林省2018届九年级中考模拟化学试卷 题型:单选题
在AlCl3溶液中逐滴加入NaOH溶液至过量,发生如下反应:3NaOH+AlCl3=Al(OH)3↓+3NaCl, Al(OH)3+NaOH=NaAlO2+2H2O。已知NaAlO2易溶于水,则下列图像不正确的是( )

A. A B. B C. C D. D
A 【解析】A、图中所示,随着氢氧化钠溶液的滴加,溶液中水的质量逐渐增大,当加入一定量时会出现滴加氢氧化钠溶液,而水的质量不增加的阶段而后继续增加;而反应的事实却是溶液中水会随着氢氧化钠溶液的滴加而不断增加,错误;B、图中所示,随着氢氧化钠的滴加,溶液中的氯化铝不断形成氢氧化铝沉淀,沉淀质量逐渐增加;至完全反应后,随着氢氧化钠的滴加沉淀逐渐减少;符合氯化铝先与氢氧化钠生成氢氧化铝沉淀,然后沉...查看答案和解析>>
科目:初中化学 来源:甘肃省2018届九年级下学期第二次月考化学试卷 题型:填空题
化学知识常常可以用来解释历史问题:《三国演义》中的“之战”,曹操率百万大军,却被周瑜的火攻和孔明“借”来的东风弄得大败而逃.用燃烧三个条件回答:曹军的木船是________;“火箭”能使木船着火的原因是________;孔明“借”来的“东风”不仅使火势吹向曹营,还为提供了________,使火烧得更旺.
可燃物 提供热量,使木船达到着火点 充足的氧气 【解析】木船属于可燃物;“火箭”能提供热量,使木船达到着火点,满足使木船着火燃烧的所有条件;随着风吹空气流动,使火场得到氧气补充,燃烧更加剧烈,所以孔明“借”来的“东风”不仅使火势吹向曹营,还为燃烧提供了充足的氧气,使火势烧得更旺。查看答案和解析>>
科目:初中化学 来源:广东省深圳市2018届九年级模拟化学试卷 题型:单选题
如图为甲乙两种固体在水中的溶解度曲线,下列说法正确的是( )

A. t2℃时,将甲乙两种物质的饱和溶液降低至t1℃,仍为饱和溶液
B. t1℃时,甲乙饱和溶液的溶质质量分数为20%
C. 甲物质中混有少量乙,可采用蒸发溶剂方法提纯甲
D. t2℃时,N点表示乙物质的不饱和溶液
B 【解析】A、甲物质的溶解度随温度的升高而升高,乙物质的溶解度随温度的升高而降低,故温度由t2℃降低到t1℃时,甲物质仍然是饱和溶液,乙物质变为不饱和溶液,故错误。 B、t1℃时甲乙物质的溶解度相等,都是25g,故甲乙物质的饱和溶液的溶质的质量分数是20%,故正确; C、甲物质的溶解度随温度的升高而升高,乙物质的溶解度随温度的升高而降低,甲物质中混有少量乙,可采用降温结晶的方法...查看答案和解析>>
科目:初中化学 来源:广东省深圳市2018届九年级模拟化学试卷 题型:单选题
化学在生产、生活中应用广泛。下列说法错误的是()
A、安全常识 室内煤气泄漏﹣﹣立即打开排风扇 浓硫酸沾到到皮肤上﹣﹣立即用水清洗 | B、元素与人体健康 人体缺铁﹣﹣易引起贫血 人体缺氟﹣﹣易产生龋齿 |
C、生活常识 洗涤剂洗去油污﹣﹣乳化作用 煤炉取暖防中毒﹣﹣开窗通风 | D、环保与物质的利用 减少白色污染﹣﹣使用可降解塑料 减少汽车尾气污染﹣﹣使用乙醇汽油 |
A. A B. B C. C D. D
A 【解析】试题A.室内煤气泄漏时,不能立即打开排风扇,以防点燃煤气而发生事故。浓硫酸沾到到皮肤上应先用布擦去,立即用水清洗。此项不正确。B.人体缺铁易引起缺铁性贫血;人体缺氟质易产生龋齿。此项正确。C.洗涤剂含表面活性分子,有乳化作用,可用于洗去油污;煤炉取暖防易产生无色无味的一氧化碳气体,容易导致中毒;预防时应适当开窗通风。此项正确。D.普通塑料不易降解,可形成白色污染;乙醇燃烧时生成二...查看答案和解析>>
科目:初中化学 来源:广东省深圳市2018年中考化学试卷 题型:单选题
下列实验均与水有关,其相应描述正确的是( )

A. A B. B C. C D. D
C 【解析】A、水蒸发过程中只是水的状态发生改变,没有新物质生成,属于物理变化,错误;B、活性炭具有吸附性,可以吸附色素和异味,净化后的水中含有可溶性物质,属于混合物,不是纯水,错误;C、水通电分解生成氢气和氧气,说明了水是由氢元素和氧元素组成的,可以证明水的组成,正确;D、浓硫酸溶于水放热,不是吸热,错误。故选C。查看答案和解析>>
科目:初中化学 来源:福建省泉州市2018届九年级上学期教学质量检测化学试卷 题型:综合题
实验室利用下图所示装置进行相关实验,请回答问题。

(1)写出图中标号仪器的名称:a__________,b___________。
(2)用双氧水和二氧化锰制取氧气,反应的化学方程式为_______________,应选用发生装置是______(填标号);该反应中转化为氧气的氧元素的质量,占参加反应的过氧化氢中氧元素质量的质量分数是___________。
(3)二氧化碳也可用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为___________;若用此法来制取二氧化碳,应选用的发生装置是______(填标号,下同),收集装置是________。
试管 分液漏斗 2H2O22H2O+O2↑ B 50% 2NaHCO3 Na2CO3+H2O+CO2↑ A E 【解析】(1)仪器a是试管,仪器b是分液漏斗; (2)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,化学方程式为2H2O22H2O+O2↑;2个过氧化氢分子中有4个氧原子,其中2个氧原子转化为氧气分子,因此该反应中转化为氧气的氧元素...查看答案和解析>>
科目:初中化学 来源:山东省滨州市2018年中考化学试卷 题型:计算题
镁在国产大飞机C-919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图像如下),过滤,称量滤液质量为147g,求:
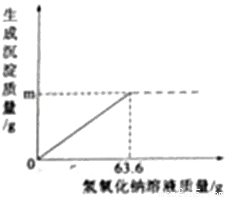
(1)图像中m=_____g。
(2)滤液中溶质的质量分数是____________?
11.6 20% 【解析】据质量守恒定律可知,反应前后物质的总质量不变。所以生成沉淀的质量=25g+70g+63.6g-147g=11.6g,设生成氯化钠的质量为y,原有氯化镁的质量为x, 2NaOH + MgCl2 == Mg(OH)2↓+ 2NaCl 95 58 117 x 11.6g y 95/x=58/11.6g x=19g 58/11.6g =117/...查看答案和解析>>
科目:初中化学 来源:福建省泉州市五校2018届九年级联考模拟化学试卷 题型:综合题
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO4•2H2O加热分解的产物
(5)分离出的CaSO4•2H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。

① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。

则G点固体的化学式是_________________。
加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分) (NH4)2SO4 常温下K2SO4的溶解度小 CaCO3 CaCO3+2HCl=CaCl2+CO2↑+H2O 检查装置的气密性 除去空气中的CO2和H2O 偏小 b、c CaSO4•H2O 【解析】(一)(1)根据将CaCO3研成粉末,碳酸钙与硫酸接触面积更大,其目的是加快反应速率解答;(2)根据质量守恒定律分析解答;(3)...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com