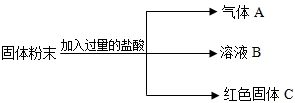
有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,做实验得以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,且上层清液为无色;
(2)该白色沉淀有一部分溶于稀硝酸,并有无色气体产生.
据此实验,下列判断中正确的是( )
A.粉末中一定含有CaCO3、Na2SO4、BaCl2
B.粉末中可能含有KNO3
C.粉末中一定不含有KNO3、CuSO4
D.粉末中一定含有Na2SO4、KNO3、BaCl2
【答案】分析:该类题中往往会有明显的现象特征,解题时就以此为突破口.(1)中题眼有“上层溶液为无色”,“白色沉淀”.(2)中“白色沉淀部分溶于稀硝酸”中的“部分溶于”,“无色气体”,抓住这些题眼可快速解答.
解答:解:固体粉末加到水中,得到白色沉淀,且上层清液为无色,说明粉末中一定没有硫酸铜,白色沉淀 可能是碳酸钙或硫酸钠与氯化钡反应产生的硫酸钡;白色沉淀部分溶于稀硝酸,说明沉淀为碳酸钙和硫酸钡,因此一定含有碳酸钙、硫酸钠和氯化钡,硝酸钾可能含有.
故选A、B、
点评:本题属于文字叙述型推断题,给出物质范围和实验现象,要求考生推出混合物中一定存在、一定不存在和可能存在的是什么物质.解答时以文字信息为序,寻找并抓住“题眼”,逐步分析“筛选”.这就要求考生熟悉这类题目的常见“题眼”,也就是解题的“突破口”.