以磷灰石矿[主要成分为:Ca5 F(PO4)3]为原料生产磷肥--过磷酸钙,其反应的化学方程式为:2Ca5 F(PO4)3+7H2SO4=7CaS04+2x+3Ca(H2PO4)2,其中x的化学式为 ;已知Ca5 F(PO4)3中P的化合价为+5价,则其中F的化合价为 .
【答案】分析:根据反应方程式2Ca5 F(PO4)3+7H2SO4=7CaS04+2x+3Ca(H2PO4)2,利用质量守恒定律来推断X的化学式,根据Ca5 F(PO4)3的化学式和P的化合价为+5价,利用化合物中正负化合价的代数和为0来计算F元素的化合价.
解答:解:在2Ca5 F(PO4)3+7H2SO4=7CaS04+2x+3Ca(H2PO4)2中,
根据质量守恒定律可知,反应前后元素种类、原子个数和种类不变,Ca、P、S、O原子的个数反应前后相等,反应前共有2个F原子、14个H原子,反应后应共有2个F原子、14个H原子,现有12个H原子,则x中共有2个F原子、2个H原子,又x的化学计量数为2,则x的化学式为HF;
在Ca5 F(PO4)3中,Ca元素的化合价为+2价,P元素的化合价为+5价,O元素的化合价为-2价,
设F元素的化合价为n,根据化合物中正负化合价的代数和为0,则
(+2)×5+n+(+5)×3+(-2)×4×3=0,
解得n=-1;
故答案为:HF;-1价.
点评:本题考查学生利用化学反应方程式来推断物质的化学式,并利用化学式来计算元素的化合价,学生应熟悉守恒法和化合价计算原则来分析解答.



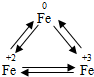 铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示:
铁广泛应用于工业生产和其他领域,它是目前最主要的一种金属材料.已知不同价态的铁元素之间能相互转化,转化关系如右图所示: