
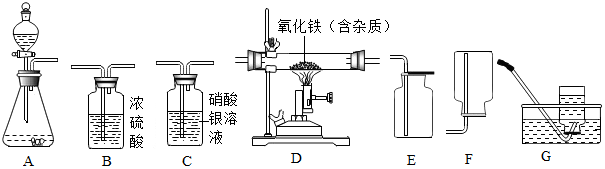
分析 (1)①根据实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气大进行分析;
②根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
③根据纯碱、熟石灰在过量的情况下,溶液显碱性,需要借助指示剂才能确保恰好完全反应进行分析;
(2)①根据氢气和氧气的混合气在点燃的条件下可能发生爆炸进行分析;
②根据连接B1的作用是吸收水,若不连接会导致水的质量变大进行分析;
③根据B2增加的质量就是生成水的质量,依据化学方程式进行计算.
解答 解:(1)①实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气大,所以所选仪器的连接顺序应为ACBE;
②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③纯碱、熟石灰在过量的情况下,溶液显碱性,需要借助指示剂才能确保恰好完全反应,所以选用的一种试剂是石灰石,实验过程是:向剩余废液中加入足量石灰石粉末,充分反应至不再有气泡冒出,过滤,滤液即为较纯净的中性液体;
(2)①氢气和氧气的混合气在点燃的条件下可能发生爆炸,所以实验开始时,要先通一会儿H2再加热,理由是:排出装置中的空气,防止加热时发生爆炸;
②连接B1的作用是吸收水,若不连接会导致水的质量变大,计算的结果偏大;
③设该样品中氧化铁的质量为x
Fe2O3+3H2$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O
160 112 54
x ag
$\frac{160}{x}$=$\frac{54}{ag}$
x=$\frac{80a}{27}$
故答案为:(1)①ACBE;
②CaCO3+2HCl=CaCl2+H2O+CO2↑;
③石灰石;向剩余废液中加入足量石灰石粉末,充分反应至不再有气泡冒出,过滤,滤液即为较纯净的中性液体;
(2)①排出装置中的空气,防止加热时发生爆炸;
②偏大;
③$\frac{80a}{27}$.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 同学们在实验室中制取二氧化碳,探究二氧化碳性质的装置图如图:
同学们在实验室中制取二氧化碳,探究二氧化碳性质的装置图如图:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠 | B. | 稀盐酸 | C. | 氢氧化钙 | D. | 水 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
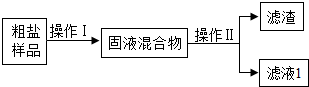
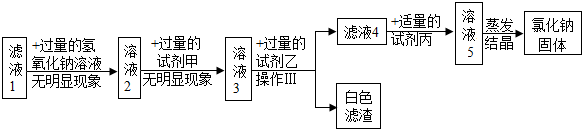
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4、ZnSO4 | B. | HCl、CuCl2 | C. | ZnSO4、CuSO4 | D. | KNO3、Hg(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com