
【题目】高速铁路作为一种安全可靠、运载量大、低碳环保的运输方式,已经成为世界铁路发展的重要趋势,根据图示回答下列问题:
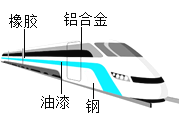
(1)图中标示的高速列车材料中,属于金属材料的是________(任写一种);
(2)高速列车使用的金属材料大多是合金而不是纯金属,这是因为合金具有更多优良性能。例如,铝合金比纯铝的硬度_______(填“大”或“小”),不锈钢锅比纯铁的抗腐蚀性_______(填“强”或“弱”)。
(3)高速列车表面喷漆除美观外,主要是为了_______。
科目:初中化学 来源: 题型:
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 40 | m |
第2次 | 40 | 14.8 |
第3次 | 40 | 12.2 |
第4次 | 40 | 11.2 |
第5次 | 40 | 11.2 |
试回答下列问题:
(1)从以上数据可知,最后剩余的11.2g固体的成分是______;表格中,m=______。
(2)黄铜样品中锌的质量分数为______。
(3)计算所用稀硫酸中硫酸的质量分数是多少____?
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如下图。

(1)左旋氧氟沙星由 种元素组成,属于 (填“有机物”或“无机物”)。
(2)左旋氧氟沙星中氧元素的质量分数是 (精确到0.1%)。
(3)成人呼吸道感染患者,一个疗程最少应服用左旋氧氟沙星 g。
(4)从保存方法看,左旋氧氟沙星可能具有 的化学性质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A的原子核外有3个电子层,且第3电子层上的电子数比第2电子层的电子数少1;B元素的某氧化物分子组成为BO3,其中B元素与氧元素的质量比为2:3,且B原子核内质子数与中子数相等(已知:元素的相对原子质量近似等于质子数加上中子数);C﹣和D2+的电子层结构与氖原子相同.
(1)写出下列微粒的符号:C﹣_____、D2+_____
已知①通常电子层数越多,微粒半径越大;②核电荷数越大,对核外电子吸引力越强,微粒半径越小.试比较以上两种离子半径的大小_____
(2)B元素形成常见单核离子的化学符号:_____,写出BO3与水反应的方程式_____
(3)已知:活泼的非金属单质能把相对不活泼的非金属单质从它的化合物中置换出来.已知A的单质比I2活泼,写出A的单质与KI反应的方程式_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在实验室做了如下实验:将镁条用砂纸擦亮,点燃后迅速伸入盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,集气瓶变热,产生一种白色粉末(MgO)和一种黑色粉末(C)。你认为他们的结论错误的是
A.该反应放出热量B.该反应前后各种元素的化合价均发生改变
C.燃烧不一定都需要氧气D.某些金属如镁的燃烧不能用二氧化碳灭火
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,老师给同学们一包粉末,该粉末可能是铜粉和氧化铁粉末中的一种或两种。为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。
(提出猜想)甲:铜粉 乙组:氧化铁粉末 丙组:_______。
(查阅资料)氧化铁与稀盐酸反应生成氯化铁和水,氯化铁溶于水
(实验探究)取少量粉末放入试管中,滴加足量的稀盐酸,振荡,观察到粉末完全消失。
(实验结论)根据以上现象证明_______(填“甲”、“乙”或“丙”)组猜想正确。
(实验拓展)同学们利用这包粉末按下图装置继续进行实验:
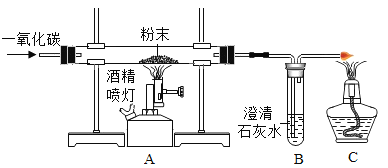
(1)实验开始应先______(填“通一氧化碳”或“点燃酒精喷灯加热”),原因是______;
(2)A处玻璃管内发生反应的化学方程式是________;同时观察到澄清石灰水变浑浊,原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
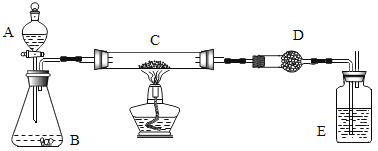
(实验用品)
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物)、浓硫酸等。
(实验内容)
实验步骤 | 实验现象 | 有关化学方程式 |
在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。 | ||
打开A的上塞、活塞,慢慢滴加溶液。 | ________ | ________ |
对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。 | ________ | ________ |
冷却后,称量D的质量为m2 g。 |
(计算)
样品中铜的质量分数=_______________________(用含W、m1、m2的代数式表示)。
问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了处理某硫酸厂废水中的硫酸,某实验小组取200g废水样品,在实验室用10%的NaOH溶液处理,下表是随着NaOH溶液的加入,废水中的pH的变化情况。请回答:
加入NaOH溶液的质量 | 14g | 16g | 18g |
所得溶液的pH | 3.7 | 7 | 12.3 |
所得溶液的溶质 | H2SO4、Na2SO4 | Na2SO4 | X |
(1)当NaOH溶液质量加到18g,所得溶液中的溶质X为_____(填化学式);
(2)求该废水中含硫酸的溶质质量分数_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4=CuSO4+H2O)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
试回答下列问题:
(1)上述表格中m的值为______,10g样品中CuO的质量为______g.
(2)计算所加入稀硫酸中溶质的质量分数?______
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数?(精确到0.1%)_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com