
(8分) 写出下列反应的化学方程式,并在括号内注明基本反应类型:
(1)煅烧石灰石 ;( );
(2)铁丝在氧气中燃烧 ;( );
(3)铜与硝酸银溶液的反应 ;( );
(4)氢氧化钙与稀盐酸的反应 ;( )。
(1)CaCO3 CaO+CO2 ↑ (分解反应)
CaO+CO2 ↑ (分解反应)
(2)3Fe+2O2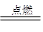 Fe3O4 (化合反应)
Fe3O4 (化合反应)
(3)2AgNO3+Cu=Cu(NO3)2+2Ag (置换反应)
(4)Ca(OH)2+2HCl=CaCl2+2H2O (复分解反应)
【解析】(1)石灰石的主要成分是碳酸钙,在高温下分解生成氧化钙和二氧化碳气体,故方程式为:CaCO3 CaO+CO2↑.该反应为一种物质生成多种物质的反应,故为分解反应;(2)铁丝和氧气在点燃的条件下生成四氧化三铁,故答案为:3Fe+2O2
CaO+CO2↑.该反应为一种物质生成多种物质的反应,故为分解反应;(2)铁丝和氧气在点燃的条件下生成四氧化三铁,故答案为:3Fe+2O2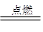 Fe3O4;该反应由两种物质反应生成一种物质,符合化合反应的概念,属于化合反应;
Fe3O4;该反应由两种物质反应生成一种物质,符合化合反应的概念,属于化合反应;
(3)因为铜在金属活动顺序表中位于银的前面,所以能从硝酸银中把银置换出来,化学方程式为Cu+2AgNO3═2Ag+Cu(NO3)2,是一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应;
(4)氢氧化钙与盐酸反应符合复分解反应的特点,即“化合物+化合物→新化合物+新化合物”,书写化学方程式时两种化合物互相交换成分,生成另外两种化合物,故化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O。


科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2010年全国中考真题专题汇编专题五 探究题(三) 题型:探究题
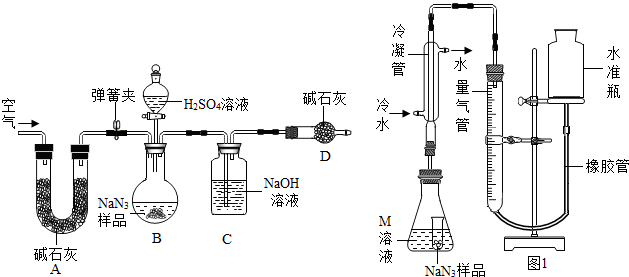
.(10扬州27). (15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
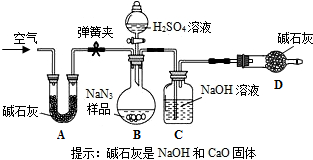
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
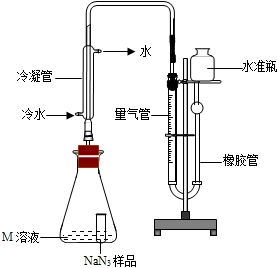
【NaN3纯度测定】精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源:专项题 题型:实验题

 3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。 
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。


(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。

(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com