
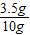 ×100%=35%
×100%=35%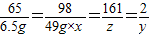
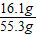 ×100%=29.1%;
×100%=29.1%;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(湖南岳阳卷)化学(解析版) 题型:计算题
称取铜、锌混合物10克置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49克稀硫酸,剩余固体3.5克,
(1)该混合物中铜的质量分数是多少?
(2)所用的稀硫酸溶质的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(湖南岳阳卷)化学(解析版) 题型:计算题
称取铜、锌混合物10克置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49克稀硫酸,剩余固体3.5克,
(1)该混合物中铜的质量分数是多少?
(2)所用的稀硫酸溶质的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
称取铜、锌混合物10克置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49克稀硫酸,剩余固体3.5克,
(1)该混合物中铜的质量分数是多少?
(2)所用的稀硫酸溶质的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com