

| 实验步骤 | 预期现象及结论 |
| 实验步骤 | 预期现象及结论 |
| 取少量反应后的溶液2份,一份加入少量碳酸钠溶液,另一份加入稀盐酸 | 若加入碳酸钠后有白色沉淀生成,则溶质是NaCl、CaCl2 若加入稀盐酸后有气泡生成,则溶质是NaCl、 Na2CO3 若加入二者后均无明显现象,则溶质是NaCl(方法合理均可) |


科目:初中化学 来源: 题型:
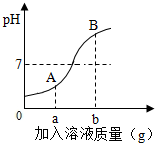 如图是稀HCl和NaOH溶液反应的pH变化曲线,以下说法正确的是( )
如图是稀HCl和NaOH溶液反应的pH变化曲线,以下说法正确的是( )| A、该反应是稀HCl滴入NaOH溶液中 |
| B、ag是指加入氢氧化钠固体质量 |
| C、A点溶液的溶质为HCl和NaCl |
| D、检验B点溶液的溶质先滴加足量的AgNO3,静置后再滴入少量Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
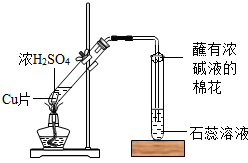 某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?他们设计了如图所示装置进行探究.
某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?他们设计了如图所示装置进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
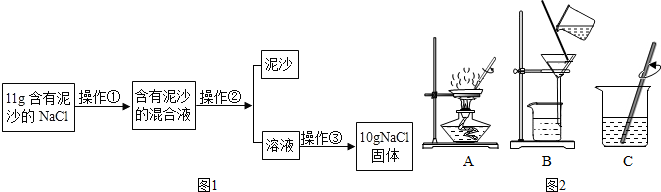
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| A、40% | B、25% |
| C、60% | D、80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com