
分析 (1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因为产生的气体逸出,故产生氢气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;因为铜的金属活动性在(H)后,不能与盐酸反应,故混合物中只有锌参与反应;利用锌与盐酸反应的化学方程式和产生的气体质量,列出比例式,就可计算出铜锌合金中锌的质量,进而计算出铜锌合金中铜的质量.然后根据质量分数公式计算即可.
(2)由气体的质量根据锌与硫酸反应的化学方程式可以计算出生成硫酸锌的质量,进而计算出硫酸锌的溶质质量分数.
解答 解:(1)根据质量守恒定律,产生氢气的质量=10g+50g-59.8g=0.2g;
设反应消耗锌的质量为x;生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}=\frac{161}{y}=\frac{2}{0.2g}$
解之得:x=6.5g;y=16.1g
该铜锌合金中铜的质量为:10g-6.5g=3.5g,
则该铜锌合金中铜的质量分数为:$\frac{3.5g}{10g}$×100%=35%.
答:该铜锌合金中铜的质量分数为35%.
(2)反应后溶液中溶质的质量分数为:$\frac{16.1g}{6.5g+50g-0.2g}×100%$≈28.6%
答:(1)样品中铜的质量分数为35%;
(2)反应后溶液中溶质的质量分数为28.6%.
点评 本题主要考查学生利用化学方程式和质量守恒定律综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:实验探究题
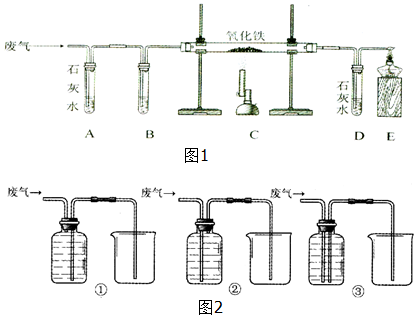
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 化学反应事实 | 影响化学反应的因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 硫在常温下不与氧气发生反应,而在点燃时能与氧气反应 | 温度 |
| C | 过氧化氢在常温下较难分解,而在加入二氧化锰后迅速分解 | 催化剂 |
| D | 煤块在空气中加热才能燃烧,而煤粉在空气中遇火星就可能爆炸 | 反应物的种类 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
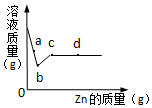 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )| A. | a点溶液中的溶质有3种 | |
| B. | 若取b~c段溶液,滴加稀盐酸,有白色沉淀 | |
| C. | c点溶液中溶质为Zn(NO3)2 | |
| D. | 取d点的固体,加入稀盐酸,无气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食醋除去暖水瓶中的薄层水垢 | |
| B. | 生锈的铁链长时间浸泡在稀盐酸中除锈 | |
| C. | 热的纯碱溶液洗涤餐具上的油污 | |
| D. | 车船表面喷涂油漆以防生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com