
| NaHCO3 | Na2CO3 | ||||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验1 |  | 向2支试管中分别加入少量Na2CO3和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
| 实验2 | 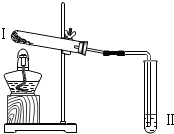 | 向II中加入试剂a,向I中加入少量Na2CO3或NaHCO3固体,分别加热一段时间 | Na2CO3受热时II中无明显现象 NaHCO3受热时II中出现浑浊 |
| 实验3 | 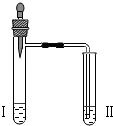 | 向II中加入试剂a,向I中加入少量5%的NaHCO3溶液,再滴加5%的CaCl2溶液 | I中出现浑浊,有气泡产生 II中出现浑浊 |
分析 (1)用质量守恒定律写碳酸氢钠和盐酸反应的化学方程式;
(2)从装置可看出是检验碳酸氢钠和碳酸钠的热稳定性,再结合二氧化碳能使澄清的石灰水变浑浊,分析解答.
(3)用质量守恒定律写NaHCO3 与 CaCl2 反应的化学方程式;
【反思与评价】
(1)根据NaHCO3是否完全分解解答;
(2)根据CaCl2溶液的溶质质量分数较小,生成的 CO2 量较少,CO2溶于水解答;
(3)根据Na2CO3和NaHCO3 固体的性质解答.
解答 解:
(1)碳酸氢钠和盐酸反应生成水和二氧化碳,故答案:NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)本实验是为检验碳酸钠和碳酸氢钠的热稳定性.所以实验中的实验步骤是加热并将产生的气体通入澄清的石灰水中;
(3)NaHCO3与CaCl2反应的化学方程式2NaHCO3+CaCl2═CaCO3↓+2NaCl+CO2↑+H2O;
【反思与评价】
(1)NaHCO3完全分解时,试管Ⅰ中残留固体成分为Na2CO3,没有完全分解时残留固体成分为Na2CO3,NaHCO3;
(2)NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,对比表格中信息可发现原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡;
(3)①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3;
②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
故答案为:
(1)NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)澄清的石灰水;
(3)CaCO3↓,2NaCl,CO2↑;
【反思与评价】
(1)Na2CO3; Na2CO3,NaHCO3;
(2)CaCl2溶液的溶质质量分数较小,生成的 CO2 量较少,CO2溶于水,因此没有气泡;
(3)①各取少量0.1%的NaHCO3和Na2CO3加入等质量的 5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3;
②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
点评 本题为典型的实验探究题,熟练掌握元素化合物的知识才能较快解答.碳酸盐和酸反应放出二氧化碳气体,二氧化碳能使石灰水变浑浊,碳酸盐溶液能和含钙离子的溶液反应生成沉淀.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
| 实验操作 |  | 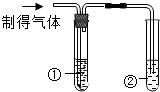 |
| 实验现象 | 澄清石灰水变浑浊 | 试管①澄清石灰水未变浑浊 试管②澄清石灰水变浑浊 |
| 实验结论 | 说明石灰水未变质 | 说明制得的气体中有CO2或二氧化碳气体 |
| 实验操作 | 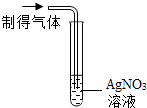 | 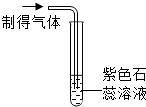 |
| 实验现象 | 出现白色沉淀 | 紫色石蕊溶液变红 |
| 实验结论 | 有HCl气体 | 有HCl气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学与生活密切相关.
化学与生活密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
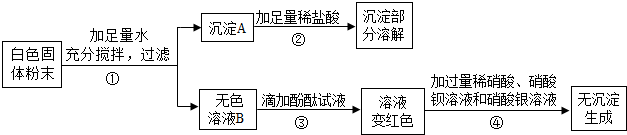
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| 实验Ⅰ | 将纯净的CO2通入到该实验所用的澄清石灰水中 | 澄清的石灰水边浑浊 | 猜想一不成立 |
| 实验Ⅱ | 将反应产生的气体通入到硝酸银溶液中 | 有白色沉淀产生 | 猜想二成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学与生活和生产密切相关:
化学与生活和生产密切相关:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用托盘天平称取10.0g氯化钠 | |
| B. | 用100mL量筒量取90.0mL 水 | |
| C. | 将称取的氯化钠倒入量筒中搅拌溶解 | |
| D. | 将配制好的溶液装入试剂瓶中,贴上标签 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com