
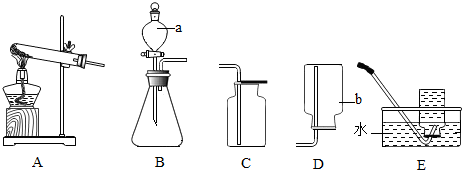
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据过氧化氢在二氧化锰的催化作用下生成水和氧气,该反应的反应物是固体和液体,反应条件是常温,E装置是排水法收集氧气,氧气有助燃性等性质进行分析;
(3)根据收集氧气的正确操作方法进行分析;
(4)根据实验室制取氨气的反应物是固体,反应条件是加热,氢气和氮气在高温高压的条件下加热生成氨气进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,a是分液漏斗,b是集气瓶;
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应的反应物是固体和液体,反应条件是常温,可选用的气体发生装置是B,E装置是排水法收集氧气,原因是:氧气不易溶于水,氧气有助燃性,所以验满的方法是:将带火星的木条放在集气瓶口,木条复燃,证明集满,该方法能够验满的原因是氧气有助燃性,该装置导管口伸到集气瓶底部的原因是氧气密度比空气大;
(3)若收集到的氧气不纯,可能的原因是:导管口一有气泡马上就收集,收集气体的集气瓶未充满水,故选:①③;
(4)氨气的一条物理性质:极易溶于水,密度比空气小,实验室制取氨气的反应物是固体,反应条件是加热,所以实验装置是A,氢气和氮气在高温高压的条件下加热生成氨气,化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
故答案为:(1)分液漏斗,集气瓶;
(2)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,B,氧气不易溶于水,将带火星的木条放在集气瓶口,木条复燃,证明集满,氧气有助燃性,该氧气密度比空气大;
(3)①③;
(4)极易溶于水,密度比空气小,A,N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洁净的空气是纯净物 | |
| B. | 测定空气中氧气的含量,可以用木炭换成铜粉 | |
| C. | 分解反应的生成物一定是单质 | |
| D. | 可吸入颗粒物又称PM10 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 含碳元素、氢元素和氧元素 | B. | 只含氢元素和氧元素 | ||
| C. | 只含氢元素和碳元素 | D. | 只含碳元素和氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁、锌、钙等微量元素能调节新陈代谢,维持身体健康 | |
| B. | 食用牡蛎等含锌海产品防治因缺锌引起的食欲不振、发育不良 | |
| C. | 食品添加剂和保健药剂能适当补充一些体内缺乏的元素,可以适当食用 | |
| D. | 用甲醛浸泡水产品,会破坏蛋白质的结构,使其变质,应禁止使用 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
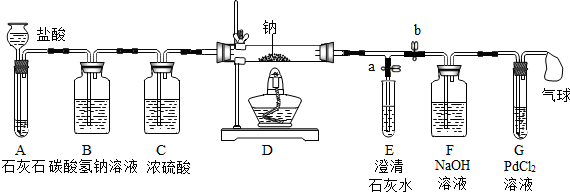
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有 C和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com