
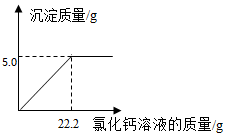
 为测定某纯碱样品(含少量的氯化钠)中碳酸钠的含量,小明称取该纯碱样品6.0g,充份溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加人氯化钙溶液的质量关系如图所示,求:(结果精确到0.1%)
为测定某纯碱样品(含少量的氯化钠)中碳酸钠的含量,小明称取该纯碱样品6.0g,充份溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加人氯化钙溶液的质量关系如图所示,求:(结果精确到0.1%)分析 (1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可.
(2)欲求所加入氯化钙溶液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%计算即可.
解答 解:设纯碱样品中碳酸钠的质量为x,加入氯化钙的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
x y 5g
$\frac{106}{x}=\frac{111}{y}=\frac{100}{5g}$
x=5.3g
y=5.55g
(1)纯碱样品中碳酸钠的质量分数为:$\frac{5.3g}{6g}×100%≈88.3%$;
(2)所加入氯化钙溶液的溶质量分数为:$\frac{5.55g}{22.2g}×100%=25%$
答:(1)该纯碱样品中碳酸钠的质量分数为88.3%.
(2)所加入氯化钙溶液的溶质量分数为25%.
点评 本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.


科目:初中化学 来源: 题型:填空题
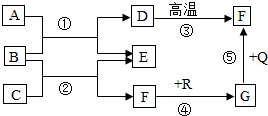 如图是初中化学中常见物质间的转化关系,其中,在通常情况下,E是生活中常用的调味剂、防腐剂,F、G是组成元素相同的两种气体,Q、R都是黑色固体(部分反应条件略去),试回答下列问题:
如图是初中化学中常见物质间的转化关系,其中,在通常情况下,E是生活中常用的调味剂、防腐剂,F、G是组成元素相同的两种气体,Q、R都是黑色固体(部分反应条件略去),试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将硝酸铵与草木灰(含碳酸钾)混合使用 | |
| B. | 纯碱既可以从内陆盐湖提取,又可以用“侯氏联合制碱法”生产 | |
| C. | 用石灰乳和硫酸铜溶液混合配制农药波尔多液 | |
| D. | 高温煅烧石灰石可以制得生石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 薄荷醇由三种元素组成 | |
| B. | 薄荷醇不属于有机物 | |
| C. | 薄荷醇由10个碳原子、20个氢原子和1个氧原子构成 | |
| D. | 薄荷醇中碳、氢、氧元素的质量比为10:20:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 5.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
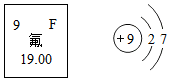 人体缺氟容易患龋齿病,如图是氟元素在元素周期表的信息和氟原子结构示意图,下列说法正确的是( )
人体缺氟容易患龋齿病,如图是氟元素在元素周期表的信息和氟原子结构示意图,下列说法正确的是( )| A. | 氟的原子核内中子数是9 | |
| B. | 氟元素属于金属元素 | |
| C. | 氟原子在化学反应中容易得到1个电子形成F- | |
| D. | 氟的相对原子质量是19.00g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
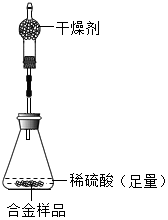 为测定某锌铜合金中锌的含量,称取该合金样品进行如图所示实验,发生反应的化学方程式是Zn+H2SO4 ZnSO4+H2↑.
为测定某锌铜合金中锌的含量,称取该合金样品进行如图所示实验,发生反应的化学方程式是Zn+H2SO4 ZnSO4+H2↑.| 反 应 前 | 充分反应后装置及反应剩余物质的质量 | |
| 装置及稀硫酸的质量 | 锌铜合金质量 | |
| 342.10 g | 16.00 g | 357.70 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com