
| 组别 | 温度 | 二氧化锰的质量 | 双氧水的浓度和体积 | 观察产生气泡的速率 |
| 1 | 室温 | 0.5g | 5%、50mL | 反应平稳,有大量气泡产生 |
| 2 | 加热 | 0.5g | 5%、50mL | 气泡急速产生,并产生大量白雾 |
| 3 | 室温 | 0.5g | 30%、50mL | 气泡呈爆发式产生,并带出反应液 |
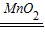 2H2O+O2↑
2H2O+O2↑

科目:初中化学 来源: 题型:
| 组别 | 温度 | 二氧化锰的质量 | 双氧水的浓度和体积 | 观察产生气泡的速率 |
| 1 | 室温 | 0.5g | 5%、50mL | 反应平稳,有大量气泡产生 |
| 2 | 加热 | 0.5g | 5%、50mL | 气泡急速产生,并产生大量白雾 |
| 3 | 室温 | 0.5g | 30%、50mL | 气泡呈爆发式产生,并带出反应液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 | 5 | |
| 金属状态 | 丝状 | 粉末状 | 丝状 | 丝状 | 丝状 | |
| 稀硫酸质量分数/% | 5 | 5 | 10 | 10 | 15 | |
| 溶液温度/℃ | 反应前 | 20 | 20 | 20 | 35 | 丢失数据 |
| 反应后 | 35 | 35 | 35 | 50 | 55 | |
| 金属消失的时间/s | 500 | 50 | 125 | 50 | 30 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 化学反应事实 | 影响化学反应 的因素 |
| A | 木炭在氧气中燃烧比在空气中燃烧更旺 | 反应物浓度 |
| B | 铜片在空气中难燃烧,纳米级铜粉在空气中易燃烧 | 反应物的种类 |
| C | H2O2在常温下分解缓慢,但在加入MnO2后迅速分解 | 催化剂 |
| D | 同种食品在夏天比冬天更容易变质 | 反应温度 |
查看答案和解析>>
科目:初中化学 来源:闸北区一模 题型:问答题
| 组别 | 温度 | 二氧化锰的质量 | 双氧水的浓度和体积 | 观察产生气泡的速率 |
| 1 | 室温 | 0.5g | 5%、50mL | 反应平稳,有大量气泡产生 |
| 2 | 加热 | 0.5g | 5%、50mL | 气泡急速产生,并产生大量白雾 |
| 3 | 室温 | 0.5g | 30%、50mL | 气泡呈爆发式产生,并带出反应液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com