

| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
分析 (1)稀硫酸和氧化铁反应生成硫酸铁和水;粉末中的碳酸钙能与硫酸反应生成二氧化碳气体;
(2)粉末状的石灰石与稀硫酸反应生成硫酸钙、水和二氧化碳;
(3)操作②是过滤,过滤所需要的玻璃仪器是烧杯、玻璃棒和漏斗;
(4)根据铁和硫酸反应生成硫酸亚铁和氢气,铁和硫酸铁反应生成硫酸亚铁进行分析;
(5)根据表中的数据可知,64℃硫酸亚铁的溶解度最大进行分析;从硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失去分析解答.
解答 解:(1)稀硫酸和氧化铁反应的化学方程式为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;粉末中的碳酸钙能与硫酸反应生成二氧化碳气体,所以当不再产生气泡就说明粉末已完全参与反应;故填:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,不再产生气泡;
(2)因为粉末状的石灰石与稀硫酸反应能够持续产生二氧化碳,因此实验室可以用粉末状的石灰石与稀硫酸反应制二氧化碳.故填:能.
(3)操作②所需要的玻璃仪器是:烧杯、玻璃棒和漏斗.玻璃棒在过滤的操作中所起的作用是引流;故填:故填:玻璃棒,引流.
(4)因为产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4,所以其中发生了铁和硫酸反应生成硫酸亚铁和氢气,铁和硫酸铁反应生成硫酸亚铁,化学方程式为:Fe+H2SO4=FeSO4+H2↑,Fe+Fe2(SO4)3=3FeSO4;故填:产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4.
(5)由表中的数据可知,64℃硫酸亚铁的溶解度最大;硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,用冰水洗涤的目的是一、除去晶体表面附着的溶于水杂质,二、冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失.
故填:64;洗去FeSO4晶体表面的杂质.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:实验探究题
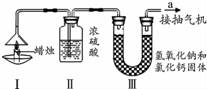 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
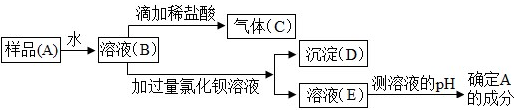
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解时产生的氢气和氧气质量比为2:1 | |
| D. | 可用肥皂水区分硬水与软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
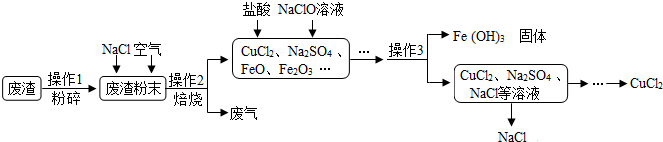
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 铁 | 铜 | 适量稀硫酸、过滤 |
| B | CaCl2溶液 | 稀盐酸 | 过量CaCO3、过滤 |
| C | ZnCl2溶液 | CuCl2 | 过量锌粉、过滤 |
| D | 氯化钠固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | 碱中都含有氢氧根,所以碱中一定含有氢元素 | |
| C. | 酸能使紫色石蕊溶液变红,CO2通入紫色石蕊后溶液变红,所以CO2是酸 | |
| D. | 有机物都含碳元素,所以含碳元素的化合物都是有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com