
| A. | 等于35% | B. | 大于35% | C. | 小于35% | D. | 无法确定 |
分析 氨水浓度越大密度越小.等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,这样混合后,所得溶液浓度当然要比15%偏小些,或根据溶质质量分数计算公式解答.
解答 解:若两种氨水等质量混合,则混合后氨水的质量分数为35%,等体积的两种氨水,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于35%.
答案:B.
点评 本题考查了有关溶质质量分数的简单计算.①密度比水大的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数大于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半).如氢氧化钠、氯化钠溶液等.同理有:②密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半).如氨水、酒精溶液等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:初中化学 来源: 题型:选择题
| A. | 加热蒸发溶剂后,再降至原温度 | B. | 加入一定量的硝酸钾 | ||
| C. | 降温至溶液刚好达到饱和 | D. | 降温后使其析出部分晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 把铝片打磨后,放入装有a:硫酸铜溶液烧杯中,观察 | 铝片表面覆盖一层b:红色的铜 | 三种金属的活动性由强到弱的顺序为: e:铝、铜、银 |
| 把铜片打磨后,放入装有c:硝酸银溶液烧杯中,观察 | 铜片表面覆盖一层d:银白色的银 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③②⑤④⑥ | B. | ②③①④⑤⑥ | C. | ⑤③②①④⑥ | D. | ③①②④⑥⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 12g碳所含的原子数就是阿伏加德罗常数 | |
| B. | 阿伏加德罗常数没有单位 | |
| C. | “物质的量”指物质的质量 | |
| D. | 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
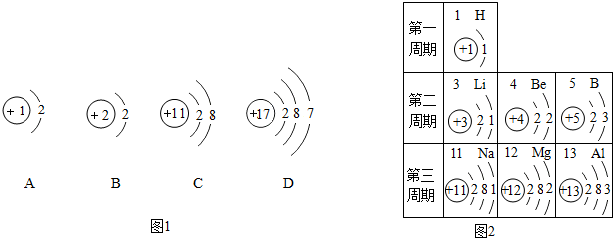
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NB | B. | BN | C. | bN | D. | B3N3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
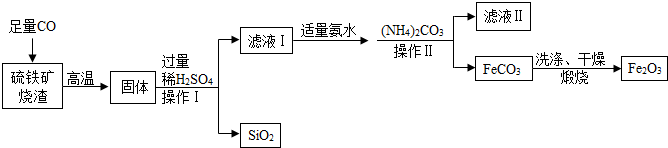
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com