
分析 (1)根据铜的物理性质分析;
(2)根据金属的性质和活动性分析;
(3)根据金属活动性顺序分析;
(4)根据铜与氧气的反应分析.
解答 (1)铜具有良好的导电性,所以铜被广泛应用与电力和电信工业,故选C;
(2)在选择铸造硬币的材料时需要考虑的因素有:金属的硬度;金属的抗氧化性;材料的可取性;材料的成本等;
①镍能与盐酸或稀硫酸反应,并放出氢气.镍与盐酸反应的化学方程式为:Ni+2HCl═H2↑+NiCl2;②用镍片、硫酸亚铁溶液和硫酸铜溶液做实验,镍片能从硫酸铜中置换出铜,但不能从硫酸亚铁溶液中置换出铁,这说明镍的活动性比铁小比铜大;
(3)将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,由于Zn的活动性比铜大比镁小,它不能置换出镁,所以滤液中一定有ZnCl2和MgCl2;
(4)五角币加热变黑,根据实验一、实验二的现象,说明铜能与氧气发生反应,铜片在空气中加热,发生的化学反应方程式为2Cu+O2$\frac{\underline{\;点燃\;}}{\;}$2CuO.
故答案为:(1)C;(2)金属的硬度;①Ni+2HCl═H2↑+NiCl2;②硫酸铜溶液;Fe>Ni>Cu;(3)ZnCl2和MgCl2;(4)氧气;Ⅰ;2Cu+O2$\frac{\underline{\;点燃\;}}{\;}$2CuO.
点评 本题综合性很强,涉及的知识点较多,全面地考查了金属的有关性质,完成此题,可以依据已有的知识进行.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
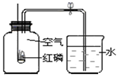
| A. | 实验中产生大量白雾 | |
| B. | 燃烧匙中的红磷可以换成木炭 | |
| C. | 本实验可以证明空气含有N2、O2、CO2和稀有气体 | |
| D. | 选用过量红磷是因为反应可以耗尽氧气,生成固态的P2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 探究目的 | 实验操作 | 实验现象 | 实验结论 |
| 探究蜡烛 燃烧的产物 | 在燃烧的蜡烛火焰上方罩一个干燥的烧杯 | 烧杯内壁产生水雾 | 蜡烛燃烧后 生成了水 |
| 立刻向上述烧杯中倒入适量的澄清石灰水,振荡 | ①澄清石灰水变白色浑浊 | 蜡烛燃烧后 生成了二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加入稀盐酸的质量/g | 剩余固体的质量/g | |
| 第一次 | 10.0 | 7.0 |
| 第二次 | 10.0 | m |
| 第三次 | 10.0 | 2.0 |
| 第四次 | 10.0 | n |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若另一种金属为镁,可能产生0.2g氢气 | |
| B. | 若另一种金属为锌,可能产生0.2g氢气 | |
| C. | 若另一种金属为铜,可能产生0.1g氢气,此时该混合物中铁的质量分数为40% | |
| D. | 若另一种金属为铝,稀盐酸中溶质质量分数一定大于7.3% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
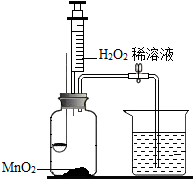 用图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.| 内容 步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
Ⅰ | 烧杯中盛有 80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有 NaOH 溶液,燃烧匙中放入硫磺,点燃硫后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2010年上海世博会的主题是“城市,让生活更美好”.
2010年上海世博会的主题是“城市,让生活更美好”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com