
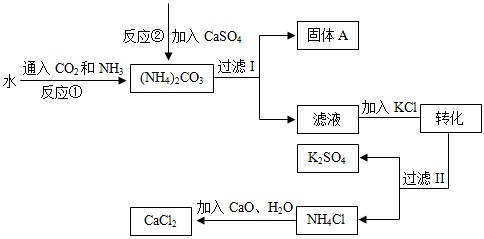
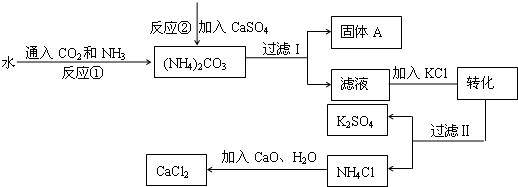
化工生产上通常将石膏(CaSO4)转化为硫酸钾肥料和氯化钙,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是该转化的流程图。

回答下列问题:
(1)写出反应①的化学方程式 。
(2)过滤I操作所得固体中,出CaSO4外还含有 (填化学式)等物质。
(3)过滤I操作所得滤液是溶液(NH4)2SO4。检验滤液中是否还含有CO32—的方法是 。
(4)已知不同温度下K2SO4的溶解度如下表:
|
温度(℃) |
0 |
20 |
60 |
|
溶解度(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体 g。
(1) 2NH3+H2O+CO2= (NH4) 2 CO3
(2)CaCO3
(3)取少量溶液,滴加稀盐酸,并将产生的气体通入澄清石灰水,若石灰水变浑浊,则还含有CO32—,反之则不含。
(4)54g
【解析】
试题分析:(1)此题为信息方程式书写。书写信息方程式,必须先确定反应物、反应条件和生成物,然后再进行配平即成化学方程式。由图知,反应物为水、二氧化碳、氨气,生成物为碳酸铵,题中没有指出明确的反应条件,则认为是通常条件下。然后用最小公倍数法配平即为答案。
(2)向(NH4) 2 CO3中加入CaSO4发生反应为(NH4) 2 CO3+ CaSO4= CaCO3↓+(NH4) 2 SO4,所以所得固体中会含有CaCO3。
(3) CO32—的检验,只需将CO32—通过加入稀酸的方法使之转化为CO2气体,并检验CO2即可判断其含碳酸根离子。这个“稀酸”可以是稀盐酸,也可是稀硫酸等其它强酸。所以答案为:取少量溶液,滴加稀盐酸,并将产生的气体通入澄清石灰水,若石灰水变浑浊,则还含有CO32—,反之则不含。
(4)查表知,60℃时K2SO4的溶解度为18.2g,0℃时K2SO4的溶解度为7.4g。根据溶解度的定义,60℃时118.2gK2SO4的饱和溶液降温到0℃,最多只能溶解7.4g硫酸钾固体,会析出18.2-7.4=10.8g硫酸钾晶体。根据题目,现K2SO4的饱和溶液为591g,则冷却后能析出晶体质量为54g。具体计算过程为:
设:可析出K2SO4固体质量为X
118.2:10.8=591:X
X=54g
考点:信息方程式书写,盐的化学性质,碳酸根离子的鉴定及溶解度计算。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:初中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com