
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合后,第三次称量的质量 | 148.30 |
分析 I、可以根据物质的性质方面进行分析、判断,从而得出I的正确的结论.如除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡可氢氧化钙微溶,所以选氢氧化钡,所以选丙;
II、(1)考虑CaCl2与稀盐酸反应生成氯化银沉淀.
(2)考虑B操作的名称是过滤,该操作需要的玻璃仪器有烧杯、漏斗、玻璃棒.
Ⅲ、(1)根据反应物和生成物及其质量守恒定律可以正确书写化学方程式;
(2)依据题目中的数据,首先分析出反应前物质的总质量及反应后物质的总质量,再结合质量守恒定律,计算出产生的气体二氧化碳的质量,再由化学方程式算得碳酸钠的质量,最后得出混合物中碳酸钠的质量分数.
解答 解:I、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去;
甲、盐酸,盐酸即与碳酸钠反应也和氢氧化钠反应,故甲方案不行;
乙、氢氧化钾和碳酸钠不反应;
丙、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡,所以选丙;
丁、氯化钙和碳酸钠生成碳酸钙沉淀,同时若氯化钙过量也会和氢氧化钠反应生成少量的氢氧化钙和碳酸钠,还有杂质,故丁方案不行;
II、(1)过第二步操作得到碳酸钙沉淀,故加入的A溶液能与碳酸钠反应生成碳酸钙沉淀,A是两种元素组成的盐,则A是CaCl2;该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是取滤液
滴入硝酸银溶液,如果有白色沉淀,则证明氯化钙过量.
(2)B操作是过滤,该操作需要的玻璃仪器有烧杯、漏斗、玻璃棒;
Ⅲ、(1)氢氧化钠、碳酸钠与稀盐酸反应的化学方程式分别为:NaOH+HCl═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)解:由题目中的数据,得出反应前物质的总质量为:9.30g+141.20g=150.50g,由35秒与55秒的质量相等可得反应后物质的总质量为:148.30g,根据质量守恒定律,可得产生的气体二氧化碳的质量为:150.50g-148.30g=2.20g,
设混合物中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
则$\frac{106}{44}=\frac{x}{2.2g}$,解得x=5.3g.
碳酸钠的质量分数为:$\frac{5.3g}{9.3g}$×100%=57%.
故答案为:
Ⅰ、丙.
Ⅱ、(1)CaCl2,取滤液,滴入硝酸银溶液.(2)过滤.烧杯、漏斗、玻璃棒.
Ⅲ、(1)NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑.(2)57%.
点评 解答本题的关键是要充分理解各种物质的性质,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:解答题
 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式.
在宏观、微观、符号之间建立联系,是化学学科特有的思维方式.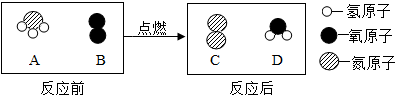
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变红 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈中性或酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
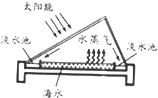
 | 石蕊试液 | 氯化钡溶液 |
| 甲车间 | 变蓝色 | 产生白色沉淀 |
| 乙车间 | 变红色 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的碱溶液:NaOH、Na2CO3、Ca(OH)2 | B. | 常见的具有还原性的物质:C、CO、O2 | ||
| C. | 常见的黑色固体:CuO、MnO2、Fe3O4 | D. | 常见的氧化物:MnO2、KClO3、H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com