
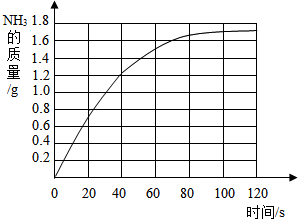
 某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:NH4Cl+NaOH
某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:NH4Cl+NaOH
| ||
| 时间 | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量/g | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
| ||
| 53.5 |
| x |
| 17 |
| 1.7g |
| 58.5 |
| y |
| 17 |
| 1.7g |
| 5.35g |
| 6g |
| 5.85g |
| 29.25g |
 ;
;

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:初中化学 来源: 题型:
| A、将氮肥硝酸铵和熟石灰混放会降低肥效 |
| B、用醋酸除去热水瓶内壁上的水垢 |
| C、被蚊子叮咬后涂抹肥皂水止痛 |
| D、冰箱内放入活性炭除去异味 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 验证方法及操作 | 可能看到的现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
 小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是
小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧生成氧化铝(Al2O3),于是设计了如右图所示的装置进行实验探究,请你结合实验过程回答下列问题.(1)集气瓶底预先铺少量沙子的目的是查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2 | 6% H2O2 |
| 催化剂 | 1g红砖粉 | 无 |
| 收集一瓶氧气的时间 | 152秒 | 几小时后都无足够氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com