
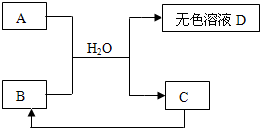
 下列A~D为初中化学常见物质,其中A为含有金属钠离子的盐,C为大理石的主要成分.它们之间存在如图关系:
下列A~D为初中化学常见物质,其中A为含有金属钠离子的盐,C为大理石的主要成分.它们之间存在如图关系:分析 A~D为初中化学常见物质,其中A为含有金属钠离子的盐,C为大理石的主要成分,则C为碳酸钙,A与B加水溶解后,反应完成碳酸钙沉淀和无色液体D,结合碳酸钙高温分解生成氧化钙和二氧化碳,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,进行分析解答.
解答 解:A~D为初中化学常见物质,其中A为含有金属钠离子的盐,C为大理石的主要成分,则C为碳酸钙,A与B加水溶解后,反应完成碳酸钙沉淀和无色液体D,结合碳酸钙高温分解生成氧化钙和二氧化碳,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,则A为碳酸钠,B为氧化钙,D为氢氧化钠.
(1)A的化学式为Na2CO3;C的化学式为CaCO3.
(2)D中一定含有的溶质是氢氧化钠.
①氧化钙与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
②碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(3)氢氧化钙微溶于水,D还可能含有反应后过量的碳酸钠,D还可能含有的溶质是碳酸钠.
故答案为:(1)Na2CO3;CaCO3;(2)氢氧化钠;①CaO+H2O═Ca(OH)2;②Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;(3)碳酸钠.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
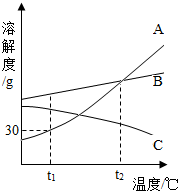 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冬天用煤炉取暖,为防止热量散失,应关紧门窗 | |
| B. | 进入古井前,应先做灯火试验 | |
| C. | 一次性塑料袋使用方便又经济,应大力提倡生产 | |
| D. | 根据外观和是否溶于水鉴别食盐和亚硝酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com