
分析 根据反应前后的质量差可以计算生成氢气的质量,根据氢气的质量可以计算锌、硫酸锌的质量,进一步可以计算锌粒中所含锌的质量分数、所得溶液的质量分数.
解答 解:(1)根据质量守恒定律,生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
答:生成了0.2g氢气.
(2)解:设锌粒中含锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x y z 0.2g
则$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.2g}$,解得x=6.5g,y=9.8g,z=16.1g,
锌粒中锌的质量分数为:$\frac{6.5g}{6.8g}×100%=95.6%$,
答:锌粒中所含锌的质量分数为95.6%.
(3)硫酸溶液里溶质的质量分数是$\frac{9.8g}{50g}×100%$=19.6%
(4)溶液的质量为:6.5g+50.0g-0.2g=56.3g,
所得溶液的质量分数为:$\frac{16.1g}{56.3g}$×100%=28.6%,
故答案为:
(1)0.2g.(2)95.6%.(3)19.6%;(4)28.6%,
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用盐酸可以去除生石灰中的少量CaCO3 | |
| B. | 用燃烧法可以区别涤纶和羊毛 | |
| C. | 用稀硫酸可以除去铁粉中混有的少量氧化铜 | |
| D. | 用Ba(NO3)2溶液可以除去稀盐酸中少量的H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
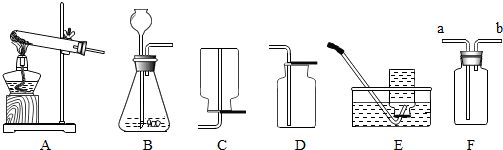
| A. | 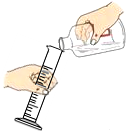 用100mL量筒量取8.5mL盐酸 用100mL量筒量取8.5mL盐酸 | B. | 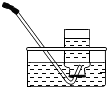 收集氢气 收集氢气 | ||
| C. | 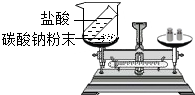 验证质量守恒定律 验证质量守恒定律 | D. |  分离碘酒中的碘 分离碘酒中的碘 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
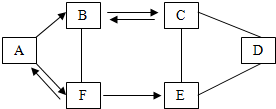 A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质,(部分反应物,生成物及反应条件已略去)请回答:查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 盐酸 | B. | AgNO3溶液 | C. | CaCl2溶液 | D. | Ba(NO3)2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验序号 | 过氧化氢溶 液浓度/% | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰用量/g | 收集氧气体积/mL | 反应所需 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 |  | 2 | 49.21 |
| ④ | 30 | 5 | 55 |  | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com